บทที่ 2 อะตอมเเละสมบัติของธาตุ
อะตอมประกอบด้วยอนุภาคที่มีขนาดเล็กมากเเละไม่สามารถมองเห็นได้ด้วยตาเปล่า ซึ่งเเนวคิดนี้ได้เริ่มขึ้นในสมัยกรีกโบราณ โดยดิโมคริตุส คำว่า อะตอม (atom) ซึ่งมาจากคำในภาษากรีก ซึ่งเเปลว่า "เเบ่งเเยกอีกไม่ได้"
2.1 เเบบจำลองอะตอม
2.1.1 แบบจำลองอะตอมของจอร์น ดอลตัน
ในปี พ.ศ. 2346 (ค.ศ. 1803) จอห์น ดอลตัน (John Dalton) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอมเพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงของสารก่อนและหลังทำปฏิกิริยา รวมทั้งอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบ ซึ่งสรุปได้ดังนี้
1. ธาตุประกอบด้วยอนุภาคเล็กๆหลายอนุภาคเรียกอนุภาคเหล่านี้ว่า “อะตอม” ซึ่งไม่สามารถแบ่งแยกได้อีก
2. อะตอมไม่สามารถทำให้เกิดใหม่และทำให้สูญหายได้
3. อะตอมของธาตุชนิดเดียวกันมีมวลเท่ากันเเละมีสมบัติเหมือนกัน
4. สารประกอบเกิดจากการรวมตัวระหว่างอะตอมด้วยอัตราส่วนที่เป็นเลขลงตัวน้อยๆ
5. อะตอมของธาตุตั้งเเต่ 2 ชนิดขึ้นไป อาจรวมตัวกันเเละเกิดสารประกอบมากกว่า 1 ชนิด
ทฤษฎีอะตอมของดอลตันใช้อธิบายลักษณะและสมบัติของอะตอมได้เพียงระดับหนึ่ง แต่ต่อมานักวิทยาศาสตร์ค้นพบข้อมูลบางประการที่ไม่สอดคล้องกับทฤษฎีอะตอมของ ดอลตัน เช่น พบว่าอะตอมของธาตุชนิดเดียวกันอาจมีมวลแตกต่างกันได้ ลักษณะแบบจำลองอะตอมของดอลตัน
"ทรงกลมตันมีขนาดเล็กที่สุดซึ้งแบ่งแยกอีกไม่ได้"
2.1.2 แบบจำลองอะตอมของทอมสัน
เซอร์โจเซฟ จอห์น ทอมสัน นักวิทยาศาสตร์ชาวอังกฤษ ได้ทำการศึกษาและทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซโดยใช้หลอดรังสีแคโทด
หลอดรังสีเเคโทด
เซอร์วิลเลียมครูกส์ เป็นผู้ประดิษฐ์หลอดรังสีเเคโทดเพื่อใช้ในการทดลองเกี่ยวกับการนำไฟฟ้าของแก๊ส ซึ่งหลอดรังสีเเคโทดมีส่วนประกอบดังนี้
1. ขั้วเเคโทด (Cathode)
2. ขั้วเเอโนด (Anode)
3. เครื่องวัดกระเเสไฟฟ้า
4. เครื่องกำเนิดไฟฟ้าศักย์สูง
เมื่อผ่านกระเเสไฟฟ้าศักย์สูงเข้าไปในหลอดรังสีเเคโทด จะเกิดรังสีพุ่งออกมาจากรังสีเเคโทดไปยังแอโนดซึ่งตรวจสอบรังสีนี้ได้ด้วยสารเรืองเเสง
เซอร์วิลเลียมครูกส์ เป็นผู้ประดิษฐ์หลอดรังสีเเคโทดเพื่อใช้ในการทดลองเกี่ยวกับการนำไฟฟ้าของแก๊ส ซึ่งหลอดรังสีเเคโทดมีส่วนประกอบดังนี้
1. ขั้วเเคโทด (Cathode)
2. ขั้วเเอโนด (Anode)
3. เครื่องวัดกระเเสไฟฟ้า
4. เครื่องกำเนิดไฟฟ้าศักย์สูง
เมื่อผ่านกระเเสไฟฟ้าศักย์สูงเข้าไปในหลอดรังสีเเคโทด จะเกิดรังสีพุ่งออกมาจากรังสีเเคโทดไปยังแอโนดซึ่งตรวจสอบรังสีนี้ได้ด้วยสารเรืองเเสง
สรุปแบบจำลองของทอมสัน
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้ อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้ อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ
"อะตอมเป็นทรงกลม ประกอบด้วยอนุภาคที่มีประจุบวก(โปรตอน)
เเละอนุภาคที่มีประจุลบ(อิเล็กตรอน) กระจายอยู่ทั่วไป
อะตอมมีสภาพเป็นกลางทางไฟฟ้า โดยมีประจุบวกเท่ากับประจุลบ"
2.1.3 แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
 หลังจากนักวิทยาศาสตร์ชาวฝรั่งเศษชื่อ เบเคอรอล ได้พบสารกัมมันตรังสี เเละเรินต์เกน ค้นพบรังสีเอ็กซ์(X-ray) รัทเทอฟอร์ดได้ทำการศึกษาธรรมชาติของรังสีที่เกิดจากสารกัมมันตรังสีพบว่ารังสีที่เกิดจากการสลายตัวของสารกัมมันตรังสีอยู่ 3 ชนิด คือ
หลังจากนักวิทยาศาสตร์ชาวฝรั่งเศษชื่อ เบเคอรอล ได้พบสารกัมมันตรังสี เเละเรินต์เกน ค้นพบรังสีเอ็กซ์(X-ray) รัทเทอฟอร์ดได้ทำการศึกษาธรรมชาติของรังสีที่เกิดจากสารกัมมันตรังสีพบว่ารังสีที่เกิดจากการสลายตัวของสารกัมมันตรังสีอยู่ 3 ชนิด คือ1.รังสีแอลฟาหรืออนุภาคแอลฟา เป็นนิวเคลียสของอะตอมฮีเลียม มีโปรตอนและนิวตรอนอย่างละ 2 อนุภาค มีประจุไฟฟ้า +2 มีเลขมวล 4 มีอำนาจทะลุทะลวงต่ำ
2.รังสีบีตาหรืออนุภาคบีตา มีสมบัติเหมือนอิเล็กตรอน มีประจุไฟฟ้า -1 มีมวลเท่ากับอิเล็กตรอน มีอำนาจทะลุทะลวงสูงกว่ารังสีแอลฟา สามารถผ่านแผ่นโลหะบางๆ ได้
3.รังสีเเกมมา เป็นคลื่อนแม่เหล็กไฟฟ้าที่มีความยาวคลื่นสั้นมาก ไม่มีประจุ ไม่มีมวล เป็นรังสีที่มีพลังงานสูง มีความเร็วเท่ากับความเร็วแสงและมีอำนาจทะลุทะลวงสูง สามารถผ่านแผ่นตะกั่วหนา 8 mm
ลอร์ดเออร์เนสท์ รัทเทอร์ฟอร์ด นักวิทยาศาสตร์ชาวนิวซีเเลนด์ เเละฮันส์ ไกเกอร์ เเละมาร์สเคน ได้ทดลองใช้อนุภาคแอลฟายิงไปยังโลหะเเผ่นบางๆ เเละใช้ฉากเรืองเเสงซึ่งฉาบด้วยซิงค์ซัลไฟด์ (ZnS) โค้งเป็นวงกลมเป็นฉากรับอนุภาคแอลฟาเพื่อตรวจสอบทิศทางการเคลื่อนที่ของอนุภาคแอลฟา
สรุปแบบจำลองอะตอมของรัทเทอร์ฟอร์ด
อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนรวมกันอยู่ตรงกลาง นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุเป็นบวก ส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบ และมีมวลน้อยมาก จะวิ่งอยู่รอบนิวเคลียสเป็นบริเวณกว้าง
อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนรวมกันอยู่ตรงกลาง นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุเป็นบวก ส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบ และมีมวลน้อยมาก จะวิ่งอยู่รอบนิวเคลียสเป็นบริเวณกว้าง
"อะตอมประกอบด้วยนิวเครียสที่มีโปรตรอนรวมกัน
อยู่ตรงกลางนิวเครียสมีขนาดเล็ก เเต่มีมวลมาก"
2.1.4 แบบจำลองอะตอมของนีลโบร์
โบร์ได้เสนอแบบจำลองขึ้นมาใหม่โดยปรับปรุงแบบจำลองอะตอมของรัทเทอร์ฟอร์ด เพื่อให้เห็นลักษณะของอิเล็กตรอนที่อยู่รอบ ๆ นิวเคลียส เป็นวงคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ ดังรูป
สรุปแบบจำลองอะตอมของบอห์ร 1. อิเล็กตรอนจะอยู่เป็นชั้น ๆ แต่ละชั้นเรียกว่า
“ ระดับพลังงาน ”
2. แต่ละระดับพลังงานจะมีอิเล็กตรอนบรรจุได้ดังนี้ จำนวนอิเล็กตรอน = 2n2
3. อิเล็กตรอนที่อยู่ในระดับพลังงานนอกสุดเรียกว่า เวเลนซ์อิเล็กตรอน ( Valence electron ) จะเป็นอิเล็กตรอนทีเกิดปฏิกิริยาต่าง ๆ ได้
4. อิเล็กตรอนที่อยู่ในระดับพลังงานวงใน อยู่ใกล้นิวเคลียสจะเสถียรมาก เพราะประจุบวกจากนิวเคลียสดึงดูดเอาไว้อย่างดี ส่วนอิเล็กตรอนระดับพลังงานวงนอกจะไม่เสถียรเพราะนิวเคลียสส่งแรงไปดึงดูดได้น้อยมาก จึงทำให้อิเล็กตรอนเหล่านี้หลุดออกจากอะตอมได้ง่าย 5. ระดับพลังงานวงในจะอยู่ห่างกันมาก ส่วนระดับพลังงานวงนอกจะอยู่ชิดกันมาก
6. การเปลี่ยนระดับพลังงานของอิเล็กตรอน ไม่จำเป็นต้องเปลี่ยนในระดับถัดกัน อาจเปลี่ยนข้ามระดับพลังงานก็ได้
"อะตอมประกอบด้วยนิวเครียสเป็นกลาง
ซึ่งมีโปรตรอนเเละนิวตรอนอยู่ภายใน
เเละมีอิเล็กตรอนวิ่งอยู่รอบๆ ในลักษณะเป็นชั้นๆ"
แบบจำลองอะตอมแบบกลุ่มหมอก แบบจำลองอะตอมของโบร์ ใช้อธิบายเกี่ยวกับเส้นสเปกตรัมของธาตุไฮโดรเจนได้ดี แต่ไม่สามารถอธิบายเส้นสเปกตรัมของอะตอมที่มีหลายอิเล็กตรอนได้ จึงได้มีการศึกษาเพิ่มเติม โดยใช้ความรู้ทางกลศาสตร์ควันตัม สร้างสมการเพื่อคำนวณหาโอกาสที่จะพบอิเล็กตรอนในระดับพลังงานต่างๆ จึงสามารถอธิบายเส้นสเปกตรัมของธาตุได้ถูกต้องกว่าอะตอมของโบร์ ลักษณะสำคัญของแบบจำลองอะตอมแบบกลุ่มหมอกอธิบายได้ดังนี้
1. อิเล็กตรอนเคลื่อนที่รอบนิวเคลียสอย่างรวดเร็วตลอดเวลาด้วยความเร็วสูง ด้วยรัศมีไม่แน่นอนจึงไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนได้บอกได้แต่เพียงโอกาสที่จะพบอิเล็กตรอนในบริเวณต่างๆ ปรากฏการณ์แบบนี้นี้เรียกว่ากลุ่มหมอกของอิเล็กตรอน บริเวณที่มีกลุ่มหมอกอิเล็กตรอนหนาแน่น จะมีโอกาสพบอิเล็กตรอนมากกว่าบริเวณที่เป็นหมอกจาง
2. การเคลื่อนที่ของอิเล็กตรอนรอบนิวเคลียสอาจเป็นรูปทรงกลมหรือรูปอื่น ๆ ขึ้นอยู่กับระดับพลังงานของอิเล็กตรอน แต่ผลรวมของกลุ่มหมอกของอิเล็กตรอนทุกระดับพลังงานจะเป็นรูปทรงกลม
"อะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเครียส
มีลักษณะเป็นทรงกลม บริเวณกลุ่มหมอกทึบเเสดงว่าโอกาส
พบอิเล็กตรอนใกล้นิวเครียสเเละบริเวณที่กลุ่มหมอกจาง
โอกาสที่จะพบอิเล็กตรอนไกลนิวเครียส"
2.2 อนุภาคในอะตอมเเละไอโซโทป2.2.1 อนุภาคในอะตอม
ในปี พ.ศ. 2451 รอเบิร์ต แอนดรูส์ มิลลิแกน นักวิทยาศาสตร์ชาวอเมริกันได้ทำการหาค่าประจุของอิเล็กตรอนโดยอาศัยการสังเกตหยดน้ำมันในสนามไฟฟ้า
การทดลองของมิลลิแกน
มิลลิแกนทดลองโดยฉีดน้ำมันเป็นฝอยเล็กๆ ซึ่งมันมีความหนาแน่นมากกว่าอากาศจึงค่อยๆตกผ่านช่องโลหะแผ่นบนลงมาชนแผ่นล่างเมื่อต่อความต่างศักย์เข้ากับแผ่นโลหะทั้งสองพบว่าบางหยดเคลื่อนที่ลง บางหยดเคลื่อนที่ขึ้นบางหยดหยุดนิ่ง หรืเคลื่อนที่ด้วยอัตราเร็วคงที่
เครื่องมือที่มิลลิแกนใช้ทดลองเป็นกล่องปิดมิดชิด ซึ่งมีส่วนประกอบที่สำคัญคือ แผ่นโลหะคู่ขนาน แผ่นบนเจาะรูเล็ก ๆ ด้านบนมีท่อสำหรับฉีดน้ำมัน ซึ่งปากกระบอกมี
รูเล็กมาก หยดน้ำมันเล็ก ๆ ที่ถูกฉีดออกมา จะเคลื่อนที่ผ่านช่องของแผ่นโลหะ โดยทั่วไปหยดน้ำมันจะมีสภาพเป็นกลางทางไฟฟ้า เมื่อเคลื่อนที่เสียดสีกับอากาศหรือปากหลอดจะทำให้หยดน้ำมันบางหยดเสียอิเล็กตรอนไปจึงมีประจุไฟฟ้าเป็นบวก และหยดน้ำมันบางหยดจะรับอิเล็กตรอนเพิ่ม ทำให้มีประจุไฟฟ้าเป็น ถ้าแผ่นโลหะไม่มีความต่างศักย์ไฟฟ้า หยดน้ำมันจะเคลื่อนที่ลงภายใต้แรงดึงดูดของโลกด้วยความเร่งเท่ากับ g เราสามารถหาประจุอิสระในหยดน้ำมันได้ โดยการปรับความต่างศักย์ไฟฟ้าระหว่างแผ่นโลหะ และถ้าจัดความต่างศักย์ไฟฟ้าให้พอเหมาะจะมี หยดน้ำมันบางหยดลอยนิ่งอยู่กับที่ หรือเคลื่อนที่ขึ้นหรือลงด้วยความเร็วคงที่ ถ้าไม่คำนึงถึงแรงลอยตัวและแรงหนืด แสดงว่าแรงที่เกิดจากสนามไฟฟ้า E และแรงโน้มถ่วงของโลกที่กระทำกับหยดน้ำมันจุมีค่าเท่ากัน
สรุปได้ว่า บนหยดน้ำมันแต่ละหยดที่มีประจุไฟฟ้าลบนั้นได้รับอิเล็กตรอนเพิ่มเป็นจำนวนต่าง ๆ กัน เช่น เป็น 2,3, 4,...ตัว โดยประจุไฟฟ้าของอิเล็กตรอนหนึ่งตัวมีขนาดเท่ากับ 1.6 x 10-19 คูลอมบ์ และใช้สัญลักษณ์ e แทนค่าประจุไฟฟ้าของอิเล็กตรอน
เครื่องมือที่มิลลิแกนใช้ทดลองเป็นกล่องปิดมิดชิด ซึ่งมีส่วนประกอบที่สำคัญคือ แผ่นโลหะคู่ขนาน แผ่นบนเจาะรูเล็ก ๆ ด้านบนมีท่อสำหรับฉีดน้ำมัน ซึ่งปากกระบอกมี
รูเล็กมาก หยดน้ำมันเล็ก ๆ ที่ถูกฉีดออกมา จะเคลื่อนที่ผ่านช่องของแผ่นโลหะ โดยทั่วไปหยดน้ำมันจะมีสภาพเป็นกลางทางไฟฟ้า เมื่อเคลื่อนที่เสียดสีกับอากาศหรือปากหลอดจะทำให้หยดน้ำมันบางหยดเสียอิเล็กตรอนไปจึงมีประจุไฟฟ้าเป็นบวก และหยดน้ำมันบางหยดจะรับอิเล็กตรอนเพิ่ม ทำให้มีประจุไฟฟ้าเป็น ถ้าแผ่นโลหะไม่มีความต่างศักย์ไฟฟ้า หยดน้ำมันจะเคลื่อนที่ลงภายใต้แรงดึงดูดของโลกด้วยความเร่งเท่ากับ g เราสามารถหาประจุอิสระในหยดน้ำมันได้ โดยการปรับความต่างศักย์ไฟฟ้าระหว่างแผ่นโลหะ และถ้าจัดความต่างศักย์ไฟฟ้าให้พอเหมาะจะมี หยดน้ำมันบางหยดลอยนิ่งอยู่กับที่ หรือเคลื่อนที่ขึ้นหรือลงด้วยความเร็วคงที่ ถ้าไม่คำนึงถึงแรงลอยตัวและแรงหนืด แสดงว่าแรงที่เกิดจากสนามไฟฟ้า E และแรงโน้มถ่วงของโลกที่กระทำกับหยดน้ำมันจุมีค่าเท่ากัน
สรุปได้ว่า บนหยดน้ำมันแต่ละหยดที่มีประจุไฟฟ้าลบนั้นได้รับอิเล็กตรอนเพิ่มเป็นจำนวนต่าง ๆ กัน เช่น เป็น 2,3, 4,...ตัว โดยประจุไฟฟ้าของอิเล็กตรอนหนึ่งตัวมีขนาดเท่ากับ 1.6 x 10-19 คูลอมบ์ และใช้สัญลักษณ์ e แทนค่าประจุไฟฟ้าของอิเล็กตรอน
อะตอมประกอบด้วยอนุภาคมูลฐานที่สำคัญ 3 อนุภาค ได้แก่ โปรตอน นิวตรอน และอิเล็กตรอน
 โปรตอนกับนิวตรอนเป็นอนุภาคที่มีน้ำหนักมากเมื่อเทียบกับอิเล็กตรอน ดังนั้นมวลของอะตอมก็คือจำนวนโปรตอนรวมกับจำนวนนิวตรอน นั่นคือ "เลขมวล" เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
โปรตอนกับนิวตรอนเป็นอนุภาคที่มีน้ำหนักมากเมื่อเทียบกับอิเล็กตรอน ดังนั้นมวลของอะตอมก็คือจำนวนโปรตอนรวมกับจำนวนนิวตรอน นั่นคือ "เลขมวล" เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
2.2.2 เลขอะตอม เลขมวล เเละไอโซโทป
จากการศึกษาเกี่ยวกับโครงสร้างของอะตอม โดยมีข้อมูลต่างๆ จากการทดลองมาสนับสนุน สรุปได้ว่า อะตอมของธาตุต่างๆ จะประกอบด้วยอิเล็กตรอน โปรตอนและนิวตรอน (ยกเว้นอะตอมของธาตุไฮโดรเจน ที่ไม่มีนิวตรอน) ซึ่งมีจำนวนแตกต่างกันไป เลขที่แสดงจ้านวนโปรตอนในนิวเคลียสของอะตอม เรียกว่าเลขอะตอม (atomic number, Z) เลขอะตอมจะเป็นค่าเฉพาะของธาตุ ธาตุชนิดเดียวกันจะมีเลขอะตอมเท่ากันเสมอ ซึ่งที่สภาวะปกติจะมีจำนวนโปรตอนและอิเล็กตรอนเท่ากัน ส่วนเลขที่แสดงจำนวนผลบวกของโปรตอนและจำนวนนิวตรอน เราเรียกว่า เลขมวล (mass number, A) ซึ่งในนิวเคลียสของอะตอม เลขมวลจะมีค่าใกล้เคียงกับเลขของอะตอม โดยผลต่างของเลขมวลกับเลขของอะตอมจะเท่ากับจำนวนนิวตรอนโดยสามารถเขียนสัญลักษณ์นิวเคลียร์ได้ คือ
2.3 การจัดเรียงอิเล็กตรอนในอะตอม
2.3.1 จำนวนอิเล็กตรอนในเเต่ละระดับพลังงาน
จากตาราง
 อะตอมที่เป็นกลางทางไฟฟ้าจะมีประจุบวกเท่ากับประจุลบ แสดงว่าในอะตอมมีจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนซึ่งในอะตอมจะมีโปรตอนจำนวนเท่ากับ "เลขอะตอม"
อะตอมที่เป็นกลางทางไฟฟ้าจะมีประจุบวกเท่ากับประจุลบ แสดงว่าในอะตอมมีจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนซึ่งในอะตอมจะมีโปรตอนจำนวนเท่ากับ "เลขอะตอม"
จำนวนโปรตอน = จำนวนอิเล็กตรอน
2.2.2 เลขอะตอม เลขมวล เเละไอโซโทป
จากการศึกษาเกี่ยวกับโครงสร้างของอะตอม โดยมีข้อมูลต่างๆ จากการทดลองมาสนับสนุน สรุปได้ว่า อะตอมของธาตุต่างๆ จะประกอบด้วยอิเล็กตรอน โปรตอนและนิวตรอน (ยกเว้นอะตอมของธาตุไฮโดรเจน ที่ไม่มีนิวตรอน) ซึ่งมีจำนวนแตกต่างกันไป เลขที่แสดงจ้านวนโปรตอนในนิวเคลียสของอะตอม เรียกว่าเลขอะตอม (atomic number, Z) เลขอะตอมจะเป็นค่าเฉพาะของธาตุ ธาตุชนิดเดียวกันจะมีเลขอะตอมเท่ากันเสมอ ซึ่งที่สภาวะปกติจะมีจำนวนโปรตอนและอิเล็กตรอนเท่ากัน ส่วนเลขที่แสดงจำนวนผลบวกของโปรตอนและจำนวนนิวตรอน เราเรียกว่า เลขมวล (mass number, A) ซึ่งในนิวเคลียสของอะตอม เลขมวลจะมีค่าใกล้เคียงกับเลขของอะตอม โดยผลต่างของเลขมวลกับเลขของอะตอมจะเท่ากับจำนวนนิวตรอนโดยสามารถเขียนสัญลักษณ์นิวเคลียร์ได้ คือ
เลขอะตอม คือ จำนวนโปรตอนในนิวเคลียสของแต่ละอะตอมของธาตุ ในอะตอมที่เป็นกลางจะมีจำนวนโปรตอนเท่ากับจ้านวนอิเล็กตรอน ดังนั้นเลขเชิงอะตอมจึงบอกจำนวนของอิเล็กตรอนของธาตุได้ด้วย เนื่องจากอะตอมของธาตุชนิดเดียวกันมีค่าเลขเชิงอะตอมเท่ากันเสมอ เลขเชิงอะตอมจึงเป็นเอกลักษณ์ของธาตุชนิดเดียวกัน เช่น เลขเชิงอะตอมของฟอสฟอรัสเท่ากับ 15 นั้นคือทุกๆ อะตอมที่เป็นกลางของฟอสฟอรัสจะมี 15 โปรตอน และมี 15 อิเล็กตรอน และกล่าวได้ว่าอะตอมใดๆ ในจักรวาลถ้ามี 15 โปรตอนแล้ว จะเรียกว่า “ฟอสฟอรัส” ทั้งสิ้น
เลขมวล คือ ผลรวมของนิวตรอนและโปรตอนที่มีในนิวเคลียสของอะตอมของธาตุ นิวเคลียสในอะตอมอื่น ๆ ทั้งหมดจะมีทั้งโปรตอนและนิวตรอนอยู่ โดยทั่วไปแล้วเลขมวลหาได้ดังนี้
เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
= เลขอะตอม + จำนวนนิวตรอน
จำนวนนิวตรอนในอะตอม = เลขมวล – เลขอะตอม
เช่น 2311Na ธาตุโซเดียม มีจำนวนโปรตอน (Z) = 11 มีจำนวนนิวตรอน = A – Z = 23 – 11 = 12 มีจำนวนอิเล็กตรอน = 11 (เท่ากับจำนวนโปรตอน)
เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
= เลขอะตอม + จำนวนนิวตรอน
จำนวนนิวตรอนในอะตอม = เลขมวล – เลขอะตอม
เช่น 2311Na ธาตุโซเดียม มีจำนวนโปรตอน (Z) = 11 มีจำนวนนิวตรอน = A – Z = 23 – 11 = 12 มีจำนวนอิเล็กตรอน = 11 (เท่ากับจำนวนโปรตอน)
ไอโซโทป (isotope) หมายถึง อะตอมของธาตุชนิดเดียวกันที่มีเลขอะตอม (Z) เท่ากัน แต่เลขมวล (A) ไม่เท่ากัน ตัวอย่างเช่น อะตอมของไฮโดรเจนมีเลขมวลสามชนิดโดยแตกต่างกันที่จำนวนนิวตรอน ได้แก่
ไฮโดรเจน (Hydrogen) มี 1 โปรตอนและไม่มีนิวตรอน มีสัญลักษณ์ 11H
ดิวทีเรียม (Deuterium) มี 1 โปรตอนและมี 1 นิวตรอน มีสัญลักษณ์ 21H
ทริเทียม (Tritium) มี 1 โปรตอนและมี 2 นิวตรอน มีสัญลักษณ์ 31H
สมบัติทางเคมีของธาตุถูกกำหนดโดยจำนวนโปรตอนและอิเล็กตรอนในอะตอม นิวตรอนไม่มีส่วนเกี่ยวข้องในการเปลี่ยนแปลงทางเคมีตามปกติ ดังนั้นไอโซโทปของธาตุเดียวกันจึงมีสมบัติทางเคมีเหมือนกันเกิดสารประกอบประเภทเดียวกันและมีความไวต่อปฏิกิริยาเคมี
ไฮโดรเจน (Hydrogen) มี 1 โปรตอนและไม่มีนิวตรอน มีสัญลักษณ์ 11H
ดิวทีเรียม (Deuterium) มี 1 โปรตอนและมี 1 นิวตรอน มีสัญลักษณ์ 21H
ทริเทียม (Tritium) มี 1 โปรตอนและมี 2 นิวตรอน มีสัญลักษณ์ 31H
สมบัติทางเคมีของธาตุถูกกำหนดโดยจำนวนโปรตอนและอิเล็กตรอนในอะตอม นิวตรอนไม่มีส่วนเกี่ยวข้องในการเปลี่ยนแปลงทางเคมีตามปกติ ดังนั้นไอโซโทปของธาตุเดียวกันจึงมีสมบัติทางเคมีเหมือนกันเกิดสารประกอบประเภทเดียวกันและมีความไวต่อปฏิกิริยาเคมี
ไอโซโทน (isotone) หมายถึง อะตอมของธาตุต่างชนิดกันที่มีจำนวนนิวตรอนเท่ากัน แต่จำนวนโปรตอน เลขอะตอมและเลขมวลไม่เท่ากัน เช่น 3919K 4020Ca มีนิวตรอนเท่ากัน คือ 20
ไอโซบาร์ (isobar) หมายถึง อะตอมของธาตุต่างชนิดกันที่มีเลขมวลเท่ากันแต่เลขอะตอมต่างกัน เช่น 146C 147N2.3 การจัดเรียงอิเล็กตรอนในอะตอม
2.3.1 จำนวนอิเล็กตรอนในเเต่ละระดับพลังงาน
อิเล็กตรอนในอะตอมที่อยู่ ณ ระดับพลังงาน (energy levels หรือ shell) จะมีพลังงานจำนวนหนึ่ง ส้าหรับอิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะมีพลังงานน้อยกว่าพวกที่อยู่ไกลออกไป ยิ่งอยู่ไกลมากยิ่งมีพลังงานมากขึ้น โดยกำหนดระดับพลังงานหลักให้เป็น n ซึ่ง n เป็นจ้านวนเต็มคือ 1, 2, … หรือตัวอักษรเรียงกันดังนี้ คือ K, L, M, N, O, P, Q ตามล้าดับ เมื่อ n = 1 จะเป็นระดับพลังงานต่ำสุด หมายความว่า จะต้องใช้พลังงานมากที่สุดที่จะดึงเอาอิเล็กตรอนนั้นออกจากอะตอมได้ จำนวนอิเล็กตรอนที่จะมีได้ในแต่ละระดับพลังงานหลักต้องเท่ากับหรือไม่เกิน 2n2 และจำนวนอิเล็กตรอนในระดับนอกสุดจะต้องไม่เกิน 8 เช่น
↑↓ เรียกว่า อิเล็กตรอนคู่ (paired electron)
↑ เรียกว่าอิเล็กตรอนเดี่ยว (single electron)
2.2) บรรจุอิเล็กตรอนเข้าไปในออร์บิทัลที่มีระดับพลังงานต่ำจนครบจำนวนก่อน
3) กฎของฮุนด์ (Hund’s rule) กล่าวว่า “การบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากัน (degenerate orbital) จะบรรจุในลักษณะที่ท้าให้มีอิเล็กตรอนเดี่ยวมากที่สุดเท่าที่จะมากได้” ออร์บิทัลที่มีระดับพลังงานมากกว่า 1 เช่น ออรฺบิทัล p และ d เป็นต้น
- ระดับพลังงานที่หนึ่ง n = 1 (shell K) ปริมาณอิเล็กตรอนที่ควรมีอยู่ = 2(1)2 = 2
- ระดับพลังงานที่สอง (n = 2) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(2)2 = 8
- ระดับพลังงานที่สาม (n = 3) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(3)2 = 18
- ระดับพลังงานที่สี่ (n = 4) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(4)2 = 32 - ระดับพลังงานที่ห้า (n = 5) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(5)2 = 50
- ระดับพลังงานที่หก (n = 6) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(6)2 = 72
- ระดับพลังงานที่เจ็ด (n = 7) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(7)2 = 98
- ระดับพลังงานที่สอง (n = 2) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(2)2 = 8
- ระดับพลังงานที่สาม (n = 3) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(3)2 = 18
- ระดับพลังงานที่สี่ (n = 4) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(4)2 = 32 - ระดับพลังงานที่ห้า (n = 5) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(5)2 = 50
- ระดับพลังงานที่หก (n = 6) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(6)2 = 72
- ระดับพลังงานที่เจ็ด (n = 7) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(7)2 = 98
2.3.2 ระดับพลังงานหลัก เเละระดับพลังงานย่อย
จากตารางได้ข้อสังเกตว่า1. ระดับพลังงานหลัก n = 1 มีเฉพาะระดับพลังงานย่อย s
1. ระดับพลังงานหลัก n = 2 มีเฉพาะระดับพลังงานย่อย s, p
ระดับพลังงานหลัก n = 3 มีเฉพาะระดับพลังงานย่อย s, p, d
ระดับพลังงานหลัก n = 4 มีเฉพาะระดับพลังงานย่อย s, p, d, f
2. ในระดับพลังงานย่อยจะมีตัวเลขข้างหน้าบอกระดับพลังงานหลัก ส่วนตัวเลขยกกำลังมุมขวาบนบอก จำนวนอิเล็กตรอนที่บรรจุได้สูงสุด เช่น
4p6 หมายความว่าระดับพลังงานหลัก n = 4 ในระดับพลังงานย่อย p-orbital มี 6 อิเล็กตรอน
4d5 หมายความว่าระดับพลังงานหลัก n = 4 ในระดับพลังงานย่อย d-orbital มี 5 อิเล็กตรอน
2.3.3 ออร์บิทัล
1. ระดับพลังงานหลัก n = 2 มีเฉพาะระดับพลังงานย่อย s, p
ระดับพลังงานหลัก n = 3 มีเฉพาะระดับพลังงานย่อย s, p, d
ระดับพลังงานหลัก n = 4 มีเฉพาะระดับพลังงานย่อย s, p, d, f
2. ในระดับพลังงานย่อยจะมีตัวเลขข้างหน้าบอกระดับพลังงานหลัก ส่วนตัวเลขยกกำลังมุมขวาบนบอก จำนวนอิเล็กตรอนที่บรรจุได้สูงสุด เช่น
4p6 หมายความว่าระดับพลังงานหลัก n = 4 ในระดับพลังงานย่อย p-orbital มี 6 อิเล็กตรอน
4d5 หมายความว่าระดับพลังงานหลัก n = 4 ในระดับพลังงานย่อย d-orbital มี 5 อิเล็กตรอน
2.3.3 ออร์บิทัล
จากการศึกษาสเปกตรัมของธาตุต่างๆ พบว่าในระดับพลังงานหลัก (n) ยังประกอบด้วยระดับพลังงานย่อยหรือเรียกว่า ซับเซลล์ (sub-levels หรือ sub-shells) โดยก้าหนดเป็นสัญลักษณ์คือ s p d และ f ซึ่งในแต่ละระดับพลังงานย่อยจะมีอิเล็กตรอนได้ไม่เท่ากันและมีพลังงานไม่เท่ากัน กล่าวคือ ระดับพลังงานย่อย s มีพลังงานต่ำกว่า p ต่ำกว่า d ต่ำกว่า f ตามล้าดับ ในระดับพลังงานย่อยยังประกอบด้วยออร์บิทัล (orbital) ซึ่งในแต่ละออร์บิทัลมีอิเล็กตรอนได้ไม่เกิน 2 อิเล็กตรอน ดังนี้
1.ระดับพลังงานย่อย s มีอิเล็กตรอนได้ไม่เกิน 2 อิเล็กตรอน มี 1 ออร์บิทัล
2.ระดับพลังงานย่อย p มีอิเล็กตรอนได้ไม่เกิน 6 อิเล็กตรอน มี 3 ออร์บิทัล
3.ระดับพลังงานย่อย d มีอิเล็กตรอนได้ไม่เกิน 10 อิเล็กตรอน มี 5 ออร์บิทัล
4.ระดับพลังงานย่อย f มีอิเล็กตรอนได้ไม่เกิน 14 อิเล็กตรอน มี 7 ออร์บิทัล
2.3.4 หลักการจัดเรียงอิเล็กตรอนในอะตอม
ภายในระดับพลังงานหลักอันเดียวกันจะประกอบด้วยพลังงานย่อยเรียงล้าดับจากพลังงานต่้าไปสูง คือ จาก s ไป p d และ f เช่น 3p สูงกว่า 3s ซึ่งเมื่อนำมาเรียงลำดับกันแล้ว พบว่ามีเฉพาะ 2 ระดับพลังงานแรกคือ n = 1 และ n = 2 เท่านั้น ที่มีพลังงานเรียงลำดับกัน แต่พอขึ้นระดับพลังงาน n = 3 เริ่มมีการซ้อนเกยกันของระดับพลังงานย่อย ดังรูป
1.ระดับพลังงานย่อย s มีอิเล็กตรอนได้ไม่เกิน 2 อิเล็กตรอน มี 1 ออร์บิทัล
2.ระดับพลังงานย่อย p มีอิเล็กตรอนได้ไม่เกิน 6 อิเล็กตรอน มี 3 ออร์บิทัล
3.ระดับพลังงานย่อย d มีอิเล็กตรอนได้ไม่เกิน 10 อิเล็กตรอน มี 5 ออร์บิทัล
4.ระดับพลังงานย่อย f มีอิเล็กตรอนได้ไม่เกิน 14 อิเล็กตรอน มี 7 ออร์บิทัล
2.3.4 หลักการจัดเรียงอิเล็กตรอนในอะตอม
ภายในระดับพลังงานหลักอันเดียวกันจะประกอบด้วยพลังงานย่อยเรียงล้าดับจากพลังงานต่้าไปสูง คือ จาก s ไป p d และ f เช่น 3p สูงกว่า 3s ซึ่งเมื่อนำมาเรียงลำดับกันแล้ว พบว่ามีเฉพาะ 2 ระดับพลังงานแรกคือ n = 1 และ n = 2 เท่านั้น ที่มีพลังงานเรียงลำดับกัน แต่พอขึ้นระดับพลังงาน n = 3 เริ่มมีการซ้อนเกยกันของระดับพลังงานย่อย ดังรูป
จากการศึกษาพบว่ากรณีของอะตอมที่มีหลายอิเล็กตรอนนั้นระดับพลังงานของ 3d จะใกล้กับ 4s มาก และพบว่า ถ้าบรรจุอิเล็กตรอนใน 4s ก่อน 3d พลังงานรวมของอะตอมจะต่ำ และอะตอมจะเสถียรกว่า ดังนั้นในการจัดเรียงอิเล็กตรอนในออร์บิทัลแบบที่เสถียรที่สุด คือการจัดตามระดับพลังงานที่ต่ำที่สุดก่อนทั้งในระดับพลังงานหลักและย่อย ซึ่งวิธีการจัดอิเล็กตรอนสามารถพิจารณาตามลูกศรในรูปที่ 1.8 โดยเรียงลำดับได้เป็น 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
ในการจัดอิเล็กตรอนอาจเขียนเป็นแผนภาพออร์บิทัลซึ่งแสดงสปินของอิเล็กตรอนด้วย ดังตัวอย่าง C มี z = 6 มีโครงแบบอิเล็กตรอนเป็น 1s2 2s2 2p2
ในการบรรจุอิเล็กตรอนหรือการจัดเรียงอิเล็กตรอนลงในออร์บิทัลจะต้องยึดหลักในการบรรจุอิเล็กตรอนของอะตอมหนึ่งๆ ลงในออร์บิทัลที่เหมาะสมตามหลักดังต่อไปนี้__________
1) หลักของเพาลี (Pauli exclusion principle) กล่าวว่า “ไม่มีอิเล็กตรอนคู่หนึ่งคู่ใดในอะตอมที่มีเลขควอนตัมทั้งสี่เหมือนกันทุกประการ” นั่นคืออิเล็กตรอนคู่หนึ่งในออร์บิทัลจะมีค่า n, ℓ, mℓ เหมือนกันได้ แต่ต่างกันที่สปิน_________
2) หลักของเอาฟ์บาว (Aufbau principle) มีวิธีการดังนี้____________๘
2) หลักของเอาฟ์บาว (Aufbau principle) มีวิธีการดังนี้____________๘
2.1) สัญลักษณ์วงกลม O, หรือ _ แทน ออร์บิทัล
ลูกศร ↑↓ แทน อิเล็กตรอน 1 ตัว ที่สปิน ขึ้น-ลง↑↓ เรียกว่า อิเล็กตรอนคู่ (paired electron)
↑ เรียกว่าอิเล็กตรอนเดี่ยว (single electron)
2.2) บรรจุอิเล็กตรอนเข้าไปในออร์บิทัลที่มีระดับพลังงานต่ำจนครบจำนวนก่อน
3) กฎของฮุนด์ (Hund’s rule) กล่าวว่า “การบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากัน (degenerate orbital) จะบรรจุในลักษณะที่ท้าให้มีอิเล็กตรอนเดี่ยวมากที่สุดเท่าที่จะมากได้” ออร์บิทัลที่มีระดับพลังงานมากกว่า 1 เช่น ออรฺบิทัล p และ d เป็นต้น
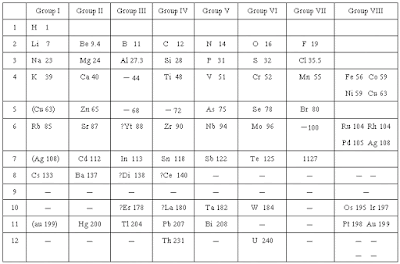
2.4 ตารางธาตุเเละสมบัติธาตุหมู่หลัก
2.4.1 วิวัฒนาการของการสร้างตารางธาตุ
ตารางธาตุ หมายถึง ตารางที่นักวิทยาศาสตร์สร้างขึ้นมา เพื่อแบ่งธาตุที่มีสมบัติเหมือนกันออกเป็นหมวดหมู่ เพื่อให้ง่ายแก่การศึกษา โดยแบ่งธาตุทั้งหมดออกเป็นหมู่และคาบ
- ธาตุที่อยู่ในแนวดิ่งเดียวกัน เรียกว่า อยู่ใน หมู่ เดียวกัน
- ธาตุที่อยู่ในแนวนอนเดียวกัน เรียกว่า อยู่ใน คาบ เดียวกัน
ในระหว่างปี พ.ศ. 2346 ถึง 2456 มีธาตุต่าง ๆที่พบในธรรมชาติประมาณ 63 ธาตุ ซึ่งนักวิทยาศาสตร์ได้พยายามจัดธาตุเหล่านี้ให้เป็นหมวดหมู่หรือเป็นตารางธาตุโดยในช่วงแรก ๆ นั้นแบ่งธาตุออกเป็นหมวดหมู่โดยอาศัยสมบัติของธาตุ ทั้งนี้ได้จากการสังเกตพบความคล้ายคลึงกันของสมบัติของธาตุเป็นกลุ่ม ๆ ทำให้นำมาจัดเป็นตารางธาตุได้ เช่นแบ่งกลุ่มโดยอาศัยสมบัติเกี่ยวกับโลหะ-อโลหะ โดยอาศัยสมบัติของความเป็นกรด-เบสของธาตุ เป็นต้น ต่อมาเมื่อหามวลอะตอมของธาตุได้ จึงใช้มวลอะตอมมาประกอบในการจัดตารางธาตุ จนในปัจจุบันจัดตารางธาตุโดยอาศัยการจัดเรียงอิเล็กตรอน
1. ตารางธาตุของเดอเบอไรเนอร์
การจัดตารางธาตุนั้นเริ่มขึ้นตั้งแต่ปี พ.ศ. 2360 (ค.ศ. 1817) โดย โยฮันน์ เดอเบอไรเนอร์ (Johaun Dobereiner) นักเคมีชาวเยอรมัน ได้นำธาตุต่าง ๆ ที่พบในขณะนั้นมาจัดเรียงเป็นตารางธาตุ โดยนำธาตุต่าง ๆ ที่มีสมบัติคล้ายคลึงกันมาจัดไว้ในหมู่เดียวกัน หมู่ละ 3 ธาตุ เรียงตามมวลอะตอมจากน้อยไปมากในแต่ละหมู่ มวลอะตอมของธาตุที่อยู่กลางจะเป็นค่าเฉลี่ยของมวลอะตอมของธาตุที่เหลืออีก 2 อะตอม เรียกว่า กฎชุดสาม (law of triads หรือ Dobereine’s law of triads)
ช่องว่างที่เว้นไว้คือตำแหน่งของธาตุที่ยังไม่พบในสมัยนั้น เนื่องจากตำแหน่งของธาตุในตารางธาตุสัมพันธ์กับสมบัติของธาตุ ทำให้เมนเดเลเอฟสามารถทำนายสมบัติของธาตุไว้ล่วงหน้าได้ด้วย โดยการศึกษาสมบัติเกี่ยวกับจุดหลอมเหลว จุดเดือด ความถ่วงจำเพาะ และความร้อนจำเพาะ รวมทั้งสมบัติเกี่ยวกับสารประกอบคลอไรด์ และออกไซด์
ตารางธาตุ หมายถึง ตารางที่นักวิทยาศาสตร์สร้างขึ้นมา เพื่อแบ่งธาตุที่มีสมบัติเหมือนกันออกเป็นหมวดหมู่ เพื่อให้ง่ายแก่การศึกษา โดยแบ่งธาตุทั้งหมดออกเป็นหมู่และคาบ
- ธาตุที่อยู่ในแนวดิ่งเดียวกัน เรียกว่า อยู่ใน หมู่ เดียวกัน
- ธาตุที่อยู่ในแนวนอนเดียวกัน เรียกว่า อยู่ใน คาบ เดียวกัน
ในระหว่างปี พ.ศ. 2346 ถึง 2456 มีธาตุต่าง ๆที่พบในธรรมชาติประมาณ 63 ธาตุ ซึ่งนักวิทยาศาสตร์ได้พยายามจัดธาตุเหล่านี้ให้เป็นหมวดหมู่หรือเป็นตารางธาตุโดยในช่วงแรก ๆ นั้นแบ่งธาตุออกเป็นหมวดหมู่โดยอาศัยสมบัติของธาตุ ทั้งนี้ได้จากการสังเกตพบความคล้ายคลึงกันของสมบัติของธาตุเป็นกลุ่ม ๆ ทำให้นำมาจัดเป็นตารางธาตุได้ เช่นแบ่งกลุ่มโดยอาศัยสมบัติเกี่ยวกับโลหะ-อโลหะ โดยอาศัยสมบัติของความเป็นกรด-เบสของธาตุ เป็นต้น ต่อมาเมื่อหามวลอะตอมของธาตุได้ จึงใช้มวลอะตอมมาประกอบในการจัดตารางธาตุ จนในปัจจุบันจัดตารางธาตุโดยอาศัยการจัดเรียงอิเล็กตรอน
1. ตารางธาตุของเดอเบอไรเนอร์
การจัดตารางธาตุนั้นเริ่มขึ้นตั้งแต่ปี พ.ศ. 2360 (ค.ศ. 1817) โดย โยฮันน์ เดอเบอไรเนอร์ (Johaun Dobereiner) นักเคมีชาวเยอรมัน ได้นำธาตุต่าง ๆ ที่พบในขณะนั้นมาจัดเรียงเป็นตารางธาตุ โดยนำธาตุต่าง ๆ ที่มีสมบัติคล้ายคลึงกันมาจัดไว้ในหมู่เดียวกัน หมู่ละ 3 ธาตุ เรียงตามมวลอะตอมจากน้อยไปมากในแต่ละหมู่ มวลอะตอมของธาตุที่อยู่กลางจะเป็นค่าเฉลี่ยของมวลอะตอมของธาตุที่เหลืออีก 2 อะตอม เรียกว่า กฎชุดสาม (law of triads หรือ Dobereine’s law of triads)
2. ตารางธาตุของนิวแลนด์
ในปี พ.ศ. 2407 (ค.ศ. 1864) จอห์น นิวแลนด์ (John Newlands) นักเคมีชาวอังกฤษได้พบว่าเมื่อนำธาตุต่าง ๆ มาเรียงลำดับตามมวลอะตอมจากน้อยไปหามาก ให้เป็นแถวตามแนวนอน สมบัติของธาตุจะมีลักษณะคล้ายกันเป็นช่วง ๆ ซึ่งลักษณะดังกล่าวเกิดขึ้นทุก ๆ ของธาตุที่ 8 เช่น ถ้าเริ่มต้นจากธาตุ Li แล้วเรียงลำดับมวลอะตอมไปถึงธาตุที่ 8 จะตรงกับ Na ซึ่ง Li และ Na มีสมบัติต่าง ๆ คล้ายคลึงกัน
3. ตารางธาตุของเมนเดเลเอฟ
ในระหว่างปี พ.ศ. 2412 - 2413 (ค.ศ. 1269 - 1270) ยูลิอุส ไมเออร์ (Julius Meyer) นัฟวิทยาศาสตร์ชาวเยอรมัน และดิมิทรี เมนเดเลเอฟ (Dimitri Mendelejev) นักวิทยาศาสตร์ชาวรัสเซียได้พบในเวลาใกล้เคียงกันว่าสมบัติต่าง ๆ ของธาตุมีส่วนสัมพันธ์กับมวลอะตอมของธาตุกล่าวคือ “ถ้าเรียงลำดับธาตุตามมวลอะตอมจากน้อยไปหามาก จะพบว่าธาตุ ๆ ต่าง จะมีสมบัติคล้ายคลึงกันเป็นช่วง ๆ ” ซึ่งเมเดเลเอฟได้ตั้งเป็นกฎเรียกว่า “กฎพิริออดิก” หรือกฎตารางธาตุ (Periodic law) และพิมพ์เผยแพร่ในปี พ.ศ. 2412 ก่อนที่ไมเออร์จะพิมพ์เผยแพร่ครั้งหนึ่ง ดังนั้นเพื่อเป็นเกียรติแก่เมนเดเลเอฟ จึงเรียกตารางนี้ว่า “ตารางพีริออดิกของเมนเดเลเอฟ” หรือตารางธาตุของเมนเดเลเอฟ (Mendelejev’ s periodic table)
ในระหว่างปี พ.ศ. 2412 - 2413 (ค.ศ. 1269 - 1270) ยูลิอุส ไมเออร์ (Julius Meyer) นัฟวิทยาศาสตร์ชาวเยอรมัน และดิมิทรี เมนเดเลเอฟ (Dimitri Mendelejev) นักวิทยาศาสตร์ชาวรัสเซียได้พบในเวลาใกล้เคียงกันว่าสมบัติต่าง ๆ ของธาตุมีส่วนสัมพันธ์กับมวลอะตอมของธาตุกล่าวคือ “ถ้าเรียงลำดับธาตุตามมวลอะตอมจากน้อยไปหามาก จะพบว่าธาตุ ๆ ต่าง จะมีสมบัติคล้ายคลึงกันเป็นช่วง ๆ ” ซึ่งเมเดเลเอฟได้ตั้งเป็นกฎเรียกว่า “กฎพิริออดิก” หรือกฎตารางธาตุ (Periodic law) และพิมพ์เผยแพร่ในปี พ.ศ. 2412 ก่อนที่ไมเออร์จะพิมพ์เผยแพร่ครั้งหนึ่ง ดังนั้นเพื่อเป็นเกียรติแก่เมนเดเลเอฟ จึงเรียกตารางนี้ว่า “ตารางพีริออดิกของเมนเดเลเอฟ” หรือตารางธาตุของเมนเดเลเอฟ (Mendelejev’ s periodic table)
เกณฑ์ที่สำคัญที่เมนเดเลเอฟใช้ คือ จัดธาตุที่มีสมบัติคล้ายคลึงกันที่ปรากฏซ้ำกันเป็นช่วง ๆ ให้อยู่ในหมู่หรือในแนวตั้งเดียวกัน และพยายามเรียงลำดับมวลอะตอมจากน้อยไปหามาก ในกรณีที่เรียงตามมวลอะตอมแล้วสมบัติของธาตุไม่สอดคล้องกัน ก็พยายามจัดให้เข้าหมู่โดยปล่อยให้ช่องว่างเว้นไว้ในตารางซึ่งเมนเดเลเอฟคิดว่า ช่องว่างเหล่านั้นน่าจะเป็นตำแหน่งของธาตุซึ่งยังไม่มีการค้นพบในขณะนั้น ในการจัดตารางธาตุนอกจากจะใช้มวลอะตอมแล้ว ยังใช้สมบัติทางเคมีและทางกายภาพของสารประกอบอื่น ๆ นอกเหนือจากสารประกอบคลอไรด์ และออกไซด์มาประกอบการพิจารณาด้วย
ช่องว่างที่เว้นไว้คือตำแหน่งของธาตุที่ยังไม่พบในสมัยนั้น เนื่องจากตำแหน่งของธาตุในตารางธาตุสัมพันธ์กับสมบัติของธาตุ ทำให้เมนเดเลเอฟสามารถทำนายสมบัติของธาตุไว้ล่วงหน้าได้ด้วย โดยการศึกษาสมบัติเกี่ยวกับจุดหลอมเหลว จุดเดือด ความถ่วงจำเพาะ และความร้อนจำเพาะ รวมทั้งสมบัติเกี่ยวกับสารประกอบคลอไรด์ และออกไซด์
4. ตารางธาตุของเฮนรี โมสลีย์
เฮนรี โมสลีย์ (Henry Moseley) นักวิทยาศาสตร์ชาวอังกฤษ ได้แก้ไขตารางธาตุของเมนเดเลเอฟให้ถูกต้องขึ้น โดยการพบว่าเลขอะตอม หรือจำนวนโปรตอนในนิวเคลียสของธาตุ มีความสัมพันธ์กับสมบัติของธาตุมากกว่ามวลอะตอม ทำให้สอดคล้องกับกฎพีริออดิกมากกว่า สามารถสร้างตารางธาตุได้โดยไม่ต้องสลับที่ธาตุบางธาตุเหมือนกรณีการจัดเรียงตามมวลอะตอม
ประมาณปี พ.ศ. 2456 (ค.ศ. 1913) โมสลีย์จึงเสนอตารางธาตุใหม่โดยเรียงตามเลขอะตอมจากน้อยไปหามาก และจัดธาตุที่มีสมบัติคล้ายคลึงกันให้อยู่ในหมู่เดียวกัน และกำหนดกฎตารางธาตุขึ้นใหม่เป็น “สมบัติต่าง ๆ ของธาตุในตารางธาตุขึ้นอยู่กับเลขอะตอมของธาตุ”
เฮนรี โมสลีย์ (Henry Moseley) นักวิทยาศาสตร์ชาวอังกฤษ ได้แก้ไขตารางธาตุของเมนเดเลเอฟให้ถูกต้องขึ้น โดยการพบว่าเลขอะตอม หรือจำนวนโปรตอนในนิวเคลียสของธาตุ มีความสัมพันธ์กับสมบัติของธาตุมากกว่ามวลอะตอม ทำให้สอดคล้องกับกฎพีริออดิกมากกว่า สามารถสร้างตารางธาตุได้โดยไม่ต้องสลับที่ธาตุบางธาตุเหมือนกรณีการจัดเรียงตามมวลอะตอม
ประมาณปี พ.ศ. 2456 (ค.ศ. 1913) โมสลีย์จึงเสนอตารางธาตุใหม่โดยเรียงตามเลขอะตอมจากน้อยไปหามาก และจัดธาตุที่มีสมบัติคล้ายคลึงกันให้อยู่ในหมู่เดียวกัน และกำหนดกฎตารางธาตุขึ้นใหม่เป็น “สมบัติต่าง ๆ ของธาตุในตารางธาตุขึ้นอยู่กับเลขอะตอมของธาตุ”
2.4.2 กลุ่มของธาตุในตารางธาตุ
ตารางธาตุแบ่งธาตุในแนวตั้งออกเป็น 18 แถวหรือ 18 หมู่ โดยธาตุทั้งหมด 18 แถว แบ่งเป็น 2 กลุ่มใหญ่ ๆ คือกลุ่ม A และ B กลุ่ม A มี 8 หมู่ คือหมู่ IA ถึง VIIIA ส่วนกลุ่ม B ซึ่งอยู่ระหว่างหมู่ IIA และ IIIA มี 8 หมู่เช่นเดียวกัน คือ หมู่ IB ถึง VIIIB (แต่มี 10 แนวตั้ง) เรียกธาตุกลุ่ม B ว่า ธาตุทรานซิชัน(Transition Elements)
ตารางธาตุแบ่งธาตุในแนวตั้งออกเป็น 18 แถวหรือ 18 หมู่ โดยธาตุทั้งหมด 18 แถว แบ่งเป็น 2 กลุ่มใหญ่ ๆ คือกลุ่ม A และ B กลุ่ม A มี 8 หมู่ คือหมู่ IA ถึง VIIIA ส่วนกลุ่ม B ซึ่งอยู่ระหว่างหมู่ IIA และ IIIA มี 8 หมู่เช่นเดียวกัน คือ หมู่ IB ถึง VIIIB (แต่มี 10 แนวตั้ง) เรียกธาตุกลุ่ม B ว่า ธาตุทรานซิชัน(Transition Elements)
ธาตุในแต่ละหมู่ ของกลุ่ม A ถ้ามีสมบัติคล้ายกันจะมีชื่อเรียกเฉพาะหมู่ เช่น
* ธาตุหมู่ IA เรียกว่า โลหะอัลคาไล (alkali metal) ได้แก่ Li , Na , K , Rb , Cs , Fr
* ธาตุหมู่ IIA เรียกว่า โลหะอัลคาไลน์เอิร์ท(alkaline earth)ได้แก่ Be Mg Ca Sr Ba Ra
* ธาตุหมู่ VIIA เรียกว่า ธาตุเฮโลเจน (halogen) ได้แก่ F Cl Br I At
* ธาตุหมู่ที่ VIIIA เรียกว่า ก๊าซเฉื่อย (Inert gas) ได้แก่ He Ne Ar Kr Xe Rn
สำหรับการแบ่งธาตุเป็นคาบ ธาตุทั้งหมดในตารางธาตุแบ่งเป็น 7 คาบ ซึ่งในแต่ละคาบอาจจะมีจำนวนธาตุไม่เท่ากัน เช่น
สำหรับคาบต่าง ๆ ในตารางธาตุแบ่งเป็น 7 คาบดังนี้
* คาบที่ 1 มี 2 ธาตุ คือ H , He
* คาบที่ 2 มี 8 ธาตุ คือ ตั้งแต่ Li ถึง Ne
* คาบที่ 3 มี 8 ธาตุ คือ ตั้งแต่ Na ถึง Ar
* คาบที่ 4 มี 18 ธาตุ คือ ตั้งแต่ K ถึง Kr
* คาบที่ 5 มี 18 ธาตุ คือ ตั้งแต่ Rb ถึง Xe
* คาบที่ 6 มี 32 ธาตุ คือ ตั้งแต่ Cs ถึง Rn
* คาบที่ 7 มี 19 ธาตุ คือ ตั้งแต่ Fr ถึง Ha
รวมทั้งหมด 105 ธาตุ เป็นก๊าซ 11 ธาตุ คือ H , N , O , F , Cl , He , Ne , Ar ,
Kr , Xe และ Rn เป็นของเหลว 5 ธาตุ คือ Cs , Fr , Hg , Ga และ Br ที่เหลือเป็นของแข็ง
สำหรับ 2 แถวล่างเลขอะตอม 57 - 70 และ 89 - 102 เป็นธาตุกลุ่มย่อยที่แยกมาจากหมู่ IIIB ในคาบที่ 6 และ 7 เรียกธาตุในกลุ่มย่อยนี้รวม ๆ ว่า กลุ่มธาตุเลนทาไนด์ และ กลุ่มธาตุแอกทิไนด์
นอกจากนี้เมื่อพิจารณาธาตุหมู่ IIIA ไปทางขวามือ จะพบเส้นหนักหรือเส้นทึบเป็นแบบขั้นบันได เส้นหนักนี้จะเป็นเส้นแบ่งกลุ่มธาตุโลหะและอโลหะ กล่าวคือ ธาตุทางขวาของเส้นขั้นบันไดจะเป็นอโลหะ ธาตุทางซ้ายมือของเส้นขั้นบันไดจะเป็นโลหะ ธาตุที่อยู่ชิดกับเส้นขั้นบันได เป็นธาตุกึ่งโลหะ ซึ่งมีทั้งสมบัติของโลหะและอโลหะ เช่น ธาตุ B , Si ,Ge ,As , Sb , Te
การตั้งชื่อธาตุที่ค้นพบใหม่
จากตารางธาตุในรูปที่ 1.23 จะพบว่ามีธาตุอยู่ 118 ธาตุ ซึ่งยังมีการค้นพบธาตุใหม่ ๆ เพิ่มขึ้นอีกหลายธาตุ แต่ยังไม่ได้กำหนดสัญลักษณ์ที่แน่นอนไว้ในตารางธาตุ ธาตุบางธาตุถูกค้นพบโดยนักวิทยาศาสตร์หลายคณะ ทำให้มีชื่อเรียกและสัญลักษณ์ต่างกัน
เช่น ธาตุที่ 104 ค้นพบโดยคณะนักวิทยาศาสตร์ 2 คณะ คือ คณะของนักวิทยาศาสตร์สหรัฐอเมริกา ซึ่งเรียกชื่อว่า รัทเทอร์ฟอร์เดียม (Ratherfordium) และใช้สัญลักษณ์ Rf ในขณะที่คณะนักวิทยาศาสตร์สหภาพโซเวียตเรียกชื่อว่าเคอร์ซาโตเวียม(Kurchatovium) ใช้สัญลักษณ์ Ku
ธาตุที่ 105 ค้นพบโดยคณะนักวิทยาศาสตร์ 2 คณะเช่นเดียวกัน คือคณะนักวิทยาศาสตร์สหรัฐอเมริกาเรียกชื่อว่า ฮาห์เนียม (Hahnium) และใช้สัญลักษณ์ Ha ในขณะที่นักวิทยาศาสตร์สหภาพโซเวียตใช้ชื่อว่า นิลส์บอห์เรียม (Neilbohrium) และใช้สัญลักษณ์เป็น Ns
การที่คณะนักวิทยาศาสตร์ต่างคณะตั้งชื่อแตกต่างกัน ทำให้เกิดความสับสน International Union of Pure and Applied Chemistry (IUPAC) จึงได้กำหนดระบบการตั้งชื่อขึ้นใหม่ โดยใช้กับชื่อธาตุที่มีเลขอะตอมเกิน 100 ขึ้นไป ทั้งนี้ให้ตั้งชื่อธาตุโดยระบุเลขอะตอมเป็นภาษาละติน แล้วลงท้ายด้วย ium ระบบการนับเลขในภาษาละตินเป็นดังนี้
0 = nil (นิล) 1 = un (อุน)
2 = bi (ไบ) 3 = tri (ไตร)
4 = quad (ควอด) 5 = pent (เพนท์)
6 = hex (เฮกซ์) 7 = sept (เซปท์)
8 = oct (ออกตฺ) 9 = enn (เอนน์)
เช่น - ธาตุที่ 104 ตามระบบ IUPAC อ่านว่า อุนนิลควอเดียม (Unnilquadium) สัญลักษณ์ Unq
- ธาตุที่ 105 ตามระบบ IUPAC อ่านว่า อุนนิลเพนเทียม (Unnilpentium) สัญลักษณ์ Unp
การจัดตารางธาตุเป็นหมู่เป็นคาบ ทำให้ศึกษาสมบัติต่าง ๆ ของธาตุได้ง่ายขึ้น สามารถทำนายสมบัติบางประการของธาตุบางธาตุได้ กล่าวคือธาตุที่อยู่ในหมู่เดียวกันจะมีสมบัติต่าง ๆ คล้าย ๆ กัน และธาตุที่อยู่ในคาบเดียวกัน จะมีแนวโน้มของการเปลี่ยนแปลงสมบัติต่าง ๆ ต่อเนื่องกันไป ซึ่งจะกล่าวถึงรายละเอียดต่อไป
2.4.3 ขนาดอะตอม
ขนาดอะตอมหาได้จากเทคนิคทาง x-ray diffraction และ microwave spectroscopy ถ้าอะตอมเรียงตัวอย่างมีระเบียบแบบชิดกันมากที่สุด ขนาดของอะตอมจะหาได้จากความสัมพันธ์ ดังนี้


(ธาตุยูเรเนียม) (ธาตุทอเลียม) (อนุภาคแอลฟา)
ขนาดอะตอมหาได้จากเทคนิคทาง x-ray diffraction และ microwave spectroscopy ถ้าอะตอมเรียงตัวอย่างมีระเบียบแบบชิดกันมากที่สุด ขนาดของอะตอมจะหาได้จากความสัมพันธ์ ดังนี้
ขนาดของ 1 อะตอม = 
จากแบบจำลองอะตอมแบบกลุ่มหมอก อะตอมมีขอบเขตที่ไม่แน่นอน ระยะระหว่างนิวเคลียสถึงผิวอะตอมมีค่าไม่คงที่ ทำให้หาขนาดของอะตอมที่แท้จริงไม่ได้ จากแบบจำลองของอะตอมตามทฤษฎีของโบร์ อิเล็กตรอนในไฮโดรเจนอะตอมอาจมีพลังงานได้หลายค่า ขนาดอะตอมของไฮโดรเจนจึงขึ้นอยู่กับว่าอิเล็กตรอนอยู่ในระดับพลังงานใด ถ้าอยู่ในระดับพลังงานสูง จะอยู่ห่างจากนิวเคลียสมาก ขนาดอะตอมจะใหญ่ และถ้าอยู่ในระดับพลังงานต่ำ จะอยู่ใกล้นิวเคลียส ขนาดอะตอมจะเล็ก ดังนั้นจึงทำให้หาขนาดของอะตอมที่แท้จริงไม่ได้
2.4.4 ขนาดไอออน
อะตอมซึ่งมีจำนวนโปรตอนเท่ากับอิเล็กตรอน เมื่อรับอิเล็กตรอนเพิ่มเข้ามาหรือเสียอิเล็กตรอนออกไปอะตอมจะกลายเป็นไอออน นักเรียนคิดว่าขนาดของไอออนกับขนาดอะตอมของธาตุเดียวกันจะแตกต่างกันหรือไม่การบอกขนาดของไอออนทำได้เช่นเดียวกับการบอกขนาดอะตอม กล่าวคือจะบอกเป็นค่ารัศมีไอออน ซึ่งพิจารณาจากระยะระหว่างนิวเคลียสของไอออนคู่หนึ่งๆ ที่มีแรงยึดเหนี่ยวซึ่งกันและกันในโครงผนึก ตัวอย่างรัศมีไอออนของ และ
และ  ในสารประกอบ MgO แสดงดังรูป
ในสารประกอบ MgO แสดงดังรูป
อะตอมซึ่งมีจำนวนโปรตอนเท่ากับอิเล็กตรอน เมื่อรับอิเล็กตรอนเพิ่มเข้ามาหรือเสียอิเล็กตรอนออกไปอะตอมจะกลายเป็นไอออน นักเรียนคิดว่าขนาดของไอออนกับขนาดอะตอมของธาตุเดียวกันจะแตกต่างกันหรือไม่การบอกขนาดของไอออนทำได้เช่นเดียวกับการบอกขนาดอะตอม กล่าวคือจะบอกเป็นค่ารัศมีไอออน ซึ่งพิจารณาจากระยะระหว่างนิวเคลียสของไอออนคู่หนึ่งๆ ที่มีแรงยึดเหนี่ยวซึ่งกันและกันในโครงผนึก ตัวอย่างรัศมีไอออนของ
- ขนาดของ Mg กับ  และ O กับ
และ O กับ  แตกต่างกันอย่างไร เพราะเหตุใด
แตกต่างกันอย่างไร เพราะเหตุใด
เมื่อโลหะทำปฏิกิริยากับอโลหะ อะตอมของโลหะจะเสียเวเลนซ์อิเล็กตรอนกลายเป็นไอออนบวก จำนวนอิเล็กตรอนในอะตอมจึงลดลง ทำให้แรงผลักระหว่างอิเล็กตรอนลดลงด้วย หรือกล่าวอีกนัยหนึ่งได้ว่าแรงดึงดูดระหว่างประจุในนิวเคลียสกับอิเล็กตรอนจะเพิ่มมากขึ้นไอออนบวกจึงมีขนาดเล็กกว่าอะตอมเดิม ส่วนอะตอมของอโลหะนั้นส่วนใหญ่จะรับอิเล็กตรอนเพิ่มเข้ามาและเกิดเป็นไอออนลบ เนื่องจากมีการเพิ่มขึ้นของจำนวนอิเล็กตรอนจึงทำให้แรงผลักระหว่างอิเล็กตรอนที่เคลื่อนที่อยู่รอบนิวเคลียสมีค่าสูงขึ้น ขอบเขตของกลุ่มหมอกอิเล็กตรอนจะขยายออกไปจากเดิม ไอออนลบจึงมีมีขนาดใหญ่กว่าอะตอมเดิม ตัวอย่างขนาดอะตอมกับขนาดไอออนของธาตุแสดงดังรูป
รัศมีอะตอมและรัศมีไอออน (พิโกเมตร) ของธาตุบางชนิด
- ขนาดไอออนตามหมู่มีแนวโน้มอย่างไร
- กับ
กับ  มีการจัดอิเล็กตรอนและขนาดไอออนแตกต่างกันหรือไม่ อย่างไร
มีการจัดอิเล็กตรอนและขนาดไอออนแตกต่างกันหรือไม่ อย่างไร
-
 และ
และ  มีขนาดไอออนแตกต่างกันอย่างไร
มีขนาดไอออนแตกต่างกันอย่างไร
-
-
จากรูป เมื่อพิจารณาแนวโน้มของรัศมีอะตอมและรัศมีไอออนตามหมู่ จะพบว่าหมู่ IA IIA IIIA และ VIIA มีแนวโน้มเช่นเดียวกันคืออะตอมและไอออนมีขนาดเพิ่มขึ้นจากบนลงล่าง รัศมีไอออนบวกจะมีค่าน้อยกว่ารัศมีอะตอมแต่รัศมีไอออนลบจะมีค่ามากกว่ารัศมีอะตอมการเปรียบเทียบขนาดไอออนที่มีความหมาย จะเปรียบเทียบระหว่างไอออนที่มีการจัดอิเล็กตรอนเหมือนกันหรือมีจำนวนอิเล็กตรอนเท่ากัน เช่น  กับ
กับ  ซึ่งมี 10 อิเล็กตรอนเท่ากันและจัดอิเล็กตรอนเป็น พบว่า
ซึ่งมี 10 อิเล็กตรอนเท่ากันและจัดอิเล็กตรอนเป็น พบว่า  มีขนาดไอออนเล็กกว่า
มีขนาดไอออนเล็กกว่า  ทั้งนี้เพราะ
ทั้งนี้เพราะ  มีประจุในนิวเคลียสมากกว่า
มีประจุในนิวเคลียสมากกว่า  ส่วนไอออนบวกที่จัดอิเล็กตรอนเหมือนกัน ไอออนบวกที่มีประจุมากจะมีขนาดเล็กกว่าไอออนบวกที่มีประจุน้อย นั่นคือไอออน 3+ จะมีขนาดเล็กกว่า 2+ และ 1+ ตามลำดับ
ส่วนไอออนบวกที่จัดอิเล็กตรอนเหมือนกัน ไอออนบวกที่มีประจุมากจะมีขนาดเล็กกว่าไอออนบวกที่มีประจุน้อย นั่นคือไอออน 3+ จะมีขนาดเล็กกว่า 2+ และ 1+ ตามลำดับ
2.4.5 พลังงานไอออไนเซซัน
พลังงานไอออไนเซชัน (ionization energy : IE) หมายถึงพลังงานที่น้อยที่สุดที่ใช้เพื่อทำให้อิเล็กตรอนหลุดออกจากอะตอมในสถานะแก๊สกลายเป็นไอออนในสถานะแก๊ส เช่น การทำให้โฮโดรเจนอะตอมกลายเป็นไฮโดรเจนไอออนในสถานะแก๊ส เขียนแสดงได้ดังนี้
H(g) --------------> H+(g) + e– IE = 1318 kJ/mol
ไฮโดรเจนมีเพียง 1 อิเล็กตรอน จึงมีค่าพลังงานไอออไนเซชันเพียงค่าเดียว ถ้าเป็นธาตุที่มีหลายอิเล็กตรอนก็จะมรพลังงานไอออไนเซชันหลายค่า พลังงานน้อยที่สุดที่ทำให้อิเล็กตรอนตัวแรกหลุดออกตากอะตอมในสถานะแก๊สเรียกว่า “พลังงานไอออไนเซชันลำดับที่ 1” เขียนย่อเป็น IE1พลังงานที่ทำให้อิเล็กตรอนตัวต่อ ๆ ไปหลุดออกจากอะตอมในสถานะแก๊สก็จะเรียกว่า พลังงานไอออไนเซชันลำดับที่ 2 , 3 , . . . ตามลำดับ และเขียนย่อเป็น IE2 , IE3 , . . . ตามลำดับ เช่น ธาตุโบรอนมี 5 อิเล็กตรอน ก็จะมีพลังงานไอออไนเซชัน 5 ค่า ดังนี้
B(g) ---------> B+(g) + e– IE1 = 807 kJ/mol
B+(g) --------> B2+(g) + e– IE2 = 2433 kJ/mol
B2+ (g) --------> B3+ (g) + e– IE3 = 3666 kJ/mol
B3+ (g) -----------> B4+ (g) + e– IE4 = 25033 kJ/mol
B4+ (g) ---------> B5+ (g) + e– IE5 = 32834 kJ/mol
พลังงานไอออไนเซชันกับจำนวนอิเล็กตรอนในระดับพลังงาน
ค่าพลังงานไอออไนเซชันของธาตุต่าง ๆ ในตารางธาตุใช้เป็นข้อมูลในการจัดกลุ่มอิเล็กตรอนที่อยู่รอบนิวเคลียส ซึ่งพบความสัมพันธ์คือ อิเล็กตรอนที่อยู่ในระดับพลังงานเดียวกัน (ชั้นเดียวกัน) จะมีค่าพลังงานไอออไนเซชันใกล้เคียงกัน และอิเล็กตรอนที่อยู่ต่างระดับพลังงานกัน จะมีค่าพลังงานไอออไนเซชันแตกต่างกันมาก ซึ่งสรุปความสัมพันธ์ถึงจำนวนอิเล็กตรอนในแต่ละระดับพลังงานจะมีจำนวนไม่เกิน 2n2
สรุปแนวโน้มพลังงานไอออไนเซชัน
1. แนวโน้มค่าพลังงานไอออไนเซชันลำดับที่ 1 ( IE1) ตามคาบ พบว่ามีแนวโน้มเพิ่มขึ้นตามเลขอะตอม เนื่องจากธาตุในคาบเดียวกันมีจำนวนโปรตอนในนิวเคลียสเพิ่มขึ้นและมีขนาดอะตอมเล็กลง แรงดึงดูดระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนจึงเพิ่มมากขึ้น อิเล็กตรอนจึงหลุดออกจากอะตอมได้ยาก
2. แนวโน้มค่าพลังงานไอออไนเซชันลำดับที่ 1 ( IE1) ตามหมู่ ปัจจัยทีมีผลคือคือขนาดอะตอมซึ่งเป็นผลมาจากระดับพลังงาน ค่า IE1จะลดลงเมื่ออะตอมมีขนาดใหญ่ขึ้น เพราะขนาดอะตอมที่ใหญ่ขึ้นจะมีเวเลนซ์อิเล็กตรอนที่ห่างนิวเคลียสมากขึ้น อิเล็กตรอนจะได้รับแรงดึงดูดจากนิวเคลียสน้อย อิเล็กตรอนจะหลุดออกจากอะตอมได้ง่าย
2.4.6 สัมพรรคภาคอิเล็กตรอน
สัมพรรคภาพอิเล็กตรอน (electron affinity) คือ พลังงานที่อะตอมในสถานะแก๊สคายออกมาเมื่อได้รับอิเล็กตรอน F(g) + e- สรุปแนวโน้มสัมพรรคภาพอิเล็กตรอน 1. เมื่อพิจารณาตามคาบ ค่า EA ในหมู่ IA IIA และ IIIA มีค่าเป็นลบน้อยกว่าธาตุที่อยู่ทางขวามือ แสดงว่าธาตุในหมู่ดังกล่าวมีแนวโน้มที่จะรับอิเล็กตรอนได้น้อยมาก โดยเฉพาะธาตุในหมู่ IIA มีค่า EA สูงที่สุด แสดงว่ารับอิเล็กตรอนยากที่สุด 2. ธาตุหมู่ IVA VA VIA และ VIIA มีแนวโน้มสูงที่จะรับอิเล็กตรอน โดยเฉพาะธาตุหมู่ VIIA ชอบที่จะรับอิเล็กตรอนสูงที่สุด การรับอิเล็กตรอนของธาตุในหมู่ VIIA จะทำให้อะตอมมีการจัดเรียงอิเล็กตรอนเหมือนแก๊สเฉื่อยซึ่งมีความเสถียรมาก EA ของแก๊สเฉื่อยจึงมีค่าเป็นบวก |
2.4.7 อิเล็กโทรเนกาติวิตี
อิเล็กโทรเนกาติวิตี (electronegativity : EN) หมายถึงค่าที่แสดงความสามารถในการดึงดูดอิเล็กตรอนของอะตอมคู่ที่เกิดพันธะที่จะรวมกันเป็นโมเลกุล ธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูงจะมีความสามารถในการดึงดูดหรือรับอิเล็กตรอนได้ดี ได้แก่พวกอโลหะ ส่วนธาตุที่มีค่าอิเล็กโทรเนกาติวิตีต่ำจะดึงดูดหรือรับอิเล็กตรอนได้ไม่ดี ได้แก่พวกโลหะ เช่น โมเลกุลของ HCl เนื่องจาก Cl ดึงดูดอิเล็กตรอนได้ดีกว่า H ดังนั้น Cl จึงมีค่าอิเล็กโทรเนกาติวิตีสูงกว่า H
สรุปแนวโน้มค่าอิเล็กโทรเนกาติวิตี
1. แนวโน้มค่าอิเล็กโทรเนกาติวิตีตามคาบ
ปัจจัยที่มีผลคือเลขอะตอมหรือประจุบวกในนิวเคลียส ธาตุที่มีประจุบวกในนิวเคลียสมากจะมีค่า EN สูง ดังนั้นธาตุที่อยู่ในคาบเดียวกันจะมีค่า EN ดังนั้นธาตุที่อยู่ในคาบเดียวกันจะมีค่า EN เพิ่มขึ้นจากซ้ายไปขวา เพราะประจุบวกที่นิวเคลียสจะส่งแรงดึงดูดกระทำต่ออิเล็กตรอนได้มาก
2. แนวโน้มค่าอิเล็กโทรเนกาติวิตีตามหมู่
ปัจจัยที่มีผลคือขนาดอะตอมซึ่งเป็นผลมาจากจำนวนระดับพลังงาน ธาตุที่มีจำนวนระดับพลังงานน้อย หรือขนาดอะตอมเล็ก จะมีค่า EN สูงกว่าธาตุที่มีขนาดอะตอมใหญ่ในหมู่เดียวกัน เพราะอะตอมที่มีขนาดใหญ่นิวเคลียสจะส่งแรงดึงดูดออกไปที่เวเลนซ์อิเล็กตรอนได้น้อย ดังนั้น “ธาตุที่อยู่ในหมู่เดียวกันจะมีค่า EN ลดลงจากบนลงล่าง”
2.5 ธาตุทรานซิซัน
2.5.1 สมบัติของธาตุแทรนซิชัน
นักเคมีจัดธาตุแทรนซิชันไว้ในกลุ่มของธาตุที่เป็นโลหะ แต่ไม่ได้เป็นกลุ่มเดียวกับธาตุหมู่ IA IIA และ IIIA เพราะเหตุใดจึงจัดธาตุแทรนซิชันไว้อีกกลุ่มหนึ่ง เพื่อตอบคำถามนี้ให้ศึกษาสมบัติของธาตุแทรนซิชันเปรียบเทียบกับสมบัติของธาตุหมู่ IA และ IIA ที่อยู่ในคาบเดียวกันจากตาราง
2.5.1 สมบัติของธาตุแทรนซิชัน
นักเคมีจัดธาตุแทรนซิชันไว้ในกลุ่มของธาตุที่เป็นโลหะ แต่ไม่ได้เป็นกลุ่มเดียวกับธาตุหมู่ IA IIA และ IIIA เพราะเหตุใดจึงจัดธาตุแทรนซิชันไว้อีกกลุ่มหนึ่ง เพื่อตอบคำถามนี้ให้ศึกษาสมบัติของธาตุแทรนซิชันเปรียบเทียบกับสมบัติของธาตุหมู่ IA และ IIA ที่อยู่ในคาบเดียวกันจากตาราง
สมบัติบางประการของโพแทสเซียม แคลเซียม และธาตุแทรนซิชันในคาบที่ 4
- ธาตุแทรนซิชันในคาบที่ 4 กับโลหะโพแทสเซียมและแคลเซียม มีสมบัติใดคล้ายกันและสมบัติใดแตกต่างกัน
จากตาราง 3.5 พบว่าธาตุแทรนซิชันในคาบที่ 4 มีสมบัติหลายประการคล้ายกับโลหะโพแทสเซียมและแคลเซียม เช่น พลังงานไอออไนเซชันลำดับที่ 1 และอิเล็กโทรเนกาติวิตีมีค่าต่ำ แต่จุดหลอมเหลว จุดเดือด และความหนาแน่นมีค่าสูง และสูงมากกว่าหมู่ IA และหมู่ IIA ธาตุเทรนซิชัน จึงควรเป็นโลหะ แต่ธาตุแทรนซิชันในคาบที่ 4 มีสมบัติบางประการที่แตกต่างจากโลหะโพแทสเซียมและแคลเซียมคือ มีขนาดอะตอมใกล้เคียงกันภายในกลุ่มของธาตุแทรนซิชันเอง แต่มีขนาดเล็กกว่าโลหะโพแทสเซียมและแคลเซียม นักเรียนคิดว่าเพราะเหตุใดจึงเป็นเช่นนั้น ให้พิจารณาการจัดเรียงอิเล็กตรอนของธาตุโพแทสเซียมแคลเซียมและธาตุแทรนซิชันในคาบที่ 4
จากตาราง 3.5 พบว่าธาตุแทรนซิชันในคาบที่ 4 มีสมบัติหลายประการคล้ายกับโลหะโพแทสเซียมและแคลเซียม เช่น พลังงานไอออไนเซชันลำดับที่ 1 และอิเล็กโทรเนกาติวิตีมีค่าต่ำ แต่จุดหลอมเหลว จุดเดือด และความหนาแน่นมีค่าสูง และสูงมากกว่าหมู่ IA และหมู่ IIA ธาตุเทรนซิชัน จึงควรเป็นโลหะ แต่ธาตุแทรนซิชันในคาบที่ 4 มีสมบัติบางประการที่แตกต่างจากโลหะโพแทสเซียมและแคลเซียมคือ มีขนาดอะตอมใกล้เคียงกันภายในกลุ่มของธาตุแทรนซิชันเอง แต่มีขนาดเล็กกว่าโลหะโพแทสเซียมและแคลเซียม นักเรียนคิดว่าเพราะเหตุใดจึงเป็นเช่นนั้น ให้พิจารณาการจัดเรียงอิเล็กตรอนของธาตุโพแทสเซียมแคลเซียมและธาตุแทรนซิชันในคาบที่ 4
การจัดเรียงอิเล็กตรอนของธาตุโพแทสเซียม แคลเซียม และธาตุแทรนซิชันในคาบที่ 4
2.6 ธาตุกัมมันตรังสี
ธาตุกัมมันตรังสี หมายถึงธาตุที่แผ่รังสีได้ เนื่องจากนิวเคลียสของอะตอมไม่เสถียร เป็นธาตุที่มีเลขอะตอมสูงกว่า 82
กัมมันตภาพรังสี หมายถึงปรากฏการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่อง รังสีที่ได้จากการสลายตัว มี 3 ชนิด คือ รังสีแอลฟา รังสีบีตา และรังสีแกมมา
กัมมันตภาพรังสี หมายถึงปรากฏการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่อง รังสีที่ได้จากการสลายตัว มี 3 ชนิด คือ รังสีแอลฟา รังสีบีตา และรังสีแกมมา
ในนิวเคลียสของธาตุประกอบด้วยโปรตอนซึ่ง มีประจุบวกและนิวตรอนซึ่งเป็นกลางทางไฟฟ้า สัดส่วนของจำนวนโปรตอนต่อจำนวนนิวตรอนไม่เหมาะสมจนทำให้ธาตุนั้นไม่เสถียร ธาตุนั้นจึงปล่อยรังสีออกมาเพื่อปรับตัวเองให้เสถียร ซึ่งเป็นกระบวนการที่เกิดขึ้นเองตามธรรมชาติ เช่น
(ธาตุยูเรเนียม) (ธาตุทอเลียม) (อนุภาคแอลฟา)
จะเห็นได้ว่า การแผ่รังสีจะทำให้เกิดธาตุใหม่ได้ หรืออาจเป็นธาตุเดิมแต่จำนวนโปรตอนหรือนิวตรอนอาจไม่เท่ากับธาตุเดิม และธาตุกัมมันตรังสีแต่ละธาตุ มีระยะเวลาในการสลายตัวแตกต่างกันและแผ่รังสีได้แตกต่างกัน เรียกว่า ครึ่งชีวิตของธาตุ
กัมมันตภาพรังสี (Radioactivity) เป็นคุณสมบัติของธาตุและไอโซโทปบางส่วน ที่สามารถเปลี่ยนแปลงตัวเองเป็นธาตุหรือไอโซโทปอื่น ซึ่งการเปลี่ยนแปลงนี้จะมีการปลดปล่อยหรือส่งรังสีออกมาด้วย ปรากฏการณ์นี้ได้พบครั้งแรกโดย เบคเคอเรล เมื่อปี พ.ศ. 2439 ต่อ มาได้มีการพิสูจน์ทราบว่า รังสีที่แผ่ออกมาในขบวนการสลายตัวของธาตุหรือไอโซโทปนั้นประกอบด้วย รังสีแอลฟา, รังสีเบต้า และรังสีแกมมา
รังสีแอลฟา
รังสีที่ประกอบด้วยอนุภาคแอลฟาซึ่งเป็นอนุภาคที่มีมวล 4 amu มีประจุ +2 อนุภาคชนิดนี้จะถูกกั้นไว้ด้วยแผ่นกระดาษหรือเพียงแค่ผิวหนังชั้นนอกของคนเราเท่านั้น
รังสีที่ประกอบด้วยอนุภาคแอลฟาซึ่งเป็นอนุภาคที่มีมวล 4 amu มีประจุ +2 อนุภาคชนิดนี้จะถูกกั้นไว้ด้วยแผ่นกระดาษหรือเพียงแค่ผิวหนังชั้นนอกของคนเราเท่านั้น
การสลายตัวให้รังสีแอลฟา
90Th 232----->88Ra 228 + 2a 4
90Th 232----->88Ra 228 + 2a 4
รังสีเบต้า
รังสี ที่ประกอบด้วยอนุภาคอิเลคตรอนหรือโพสิตรอน รังสีนี้มีคุณสมบัติทะลุทะลวงตัวกลางได้ดีกว่ารังสีแอลฟา สามารถทะลุผ่านน้ำที่ลึกประมาณ 1 นิ้วหรือประมาณความหนาของผิวเนื้อที่ฝ่ามือได้ รังสีเบต้าจะถูกกั้นได้โดยใช้แผ่นอะลูมิเนียมชนิดบาง
รังสี ที่ประกอบด้วยอนุภาคอิเลคตรอนหรือโพสิตรอน รังสีนี้มีคุณสมบัติทะลุทะลวงตัวกลางได้ดีกว่ารังสีแอลฟา สามารถทะลุผ่านน้ำที่ลึกประมาณ 1 นิ้วหรือประมาณความหนาของผิวเนื้อที่ฝ่ามือได้ รังสีเบต้าจะถูกกั้นได้โดยใช้แผ่นอะลูมิเนียมชนิดบาง
การสลายตัวให้รังสีบีตา
79Au 198----->80Hg 198 + -1b 0
7N 13----->6C 13 + +1b 0
79Au 198----->80Hg 198 + -1b 0
7N 13----->6C 13 + +1b 0
รังสีแกมมา
รังสี ที่เป็นคลื่นแม่เหล็กไฟฟ้าพลังงานสูง มีคุณสมบัติเช่นเดียวกันกับรังสีเอกซ์ที่สามารถทะลุผ่านร่างกายได้ การกำบังรังสีแกมมาต้องใช้วัสดุที่มีความหนาแน่นสูงเช่น ตะกั่วหรือยูเรเนียม เป็นต้น
รังสี ที่เป็นคลื่นแม่เหล็กไฟฟ้าพลังงานสูง มีคุณสมบัติเช่นเดียวกันกับรังสีเอกซ์ที่สามารถทะลุผ่านร่างกายได้ การกำบังรังสีแกมมาต้องใช้วัสดุที่มีความหนาแน่นสูงเช่น ตะกั่วหรือยูเรเนียม เป็นต้น
การสลายตัวให้รังสีแกมมา
27Co 60----->-1b 0 + 28Ni 60----->28Ni60 + g
27Co 60----->-1b 0 + 28Ni 60----->28Ni60 + g
การสลายตัวของธาตุกัมมันตรังสี
การที่ธาตุกัมมันตรังสีแผ่รังสีได้นั้นเป็นเพราะนิวเคลียสของธาตุไม่เสถียร เนื่องจากมีพลังงานส่วนเกินอยู่ภายใน ดังนั้นจึงจำเป็นต้องถ่ายเทพพลังงานส่วนเกินนี้ออกไป เพื่อให้นิวเคลียสเสถียรในที่สุด พลังงานส่วนเกินที่ปล่อยออกมาอยู่ในรูปของอนุภาคหรือรังสีต่าง ๆ เช่น อนุภาคแอลฟา อนุภาคบีตา รังสีแกมมาและไอโชโทปที่เสถียร จากการศึกษาไอโชโทปของธาตุจำนวนมาก พบว่าไอโชโทปที่นิวเคลียสมีอัตราส่วนระหว่าจำนวนนิวตรอนต่อโปรตอนไม่เหมาะสม คือนิวเคลียสที่มีจำนวนนิวตรอนมาก หรือ น้อยกว่าจำนวนโปรตอนมักจะไม่เสถียรจะมีการแผ่รังสีออกมาจนได้ไอโชโทปของธาตุใหม่ที่เสถียรกว่า นอกจากนั้นยังพบว่าจำนวนโปรตอนและนิวตรอนที่เป็นจำนวนคู่ หรือคี่ในนิวเคลียสนั้น มีความสัมพันธ์กับความเสถียรภาพของนิวเคลียสด้วย กล่าวคือ ไอโชโทปของธาตุที่มีจำนวนโปรตอน และนิวตรอนเป็นเลขคู่ จะเสถียรกว่าไอโชโทปของธาตุที่มีจำนวนโปรตอนและนิวตอนเป็นเลขคี่เช่น 714N เป็นไอโซโทปที่เสถียร 715N พบว่า 714N มีจำนวนโปรตอนและจำนวนนิวตรอน จึงเสถียรกว่า 715Nที่มีจำนวนโปรตอนไม่เท่ากับจำนวนนิวตรอน816O เป็นไอโซโทปที่เสถียรกว่า817O เพราะ 816O มีจำนวนโปรตอนและจำนวนนิวตรอนเท่ากัน จึงเสถียรกว่า817O ที่มีจำนวนนิวตรอนเป็นเลขคี่ และจำนวนโปรตอนเป็นเลขคู่
ครึ่งชีวิตของธาตุกัมมันตรังสี
ครึ่งชีวิตของธาตุ (half life) หมายถึง ระยะเวลาที่สารสลายตัวไปจนเหลือเพียงครึ่งหนึ่งของปริมาณเดิมใช้สัญลักษณ์เป็น t1/2 นิวเคลียสของธาตุกัมมันตรังสีที่ไม่เสถียร จะสลายตัวและแผ่รังสีได้เองตลอดเวลาโดยไม่ขึ้นอยู่กับอุณหภูมิหรือความดัน อัตราการสลายตัว เป็นสัดส่วนโดยตรงกับจำนวนอนุภาคในธาตุกัมมันตรังสีนั้น ปริมาณการสลายตัวจะบอกเป็นครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป
ตัวอย่างเช่น C-14 มีครึ่งชีวิต 5730 ปี หมายความว่า ถ้ามี C-14 1 กรัม เมื่อเวลาผ่านไป 5730 ปี จะเหลือ C-14 อยู่ 0.5 กรัม และเมื่อเวลาผ่านไปอีก 5730 ปี จะเหลืออยู่ 0.25 กรัม เป็นดังนี้ไปเรื่อยๆ กล่าวได้ว่าทุกๆ 5730 ปี จะเหลือ C-14 เพียงครึ่งหนึ่งของปริมาณเดิม
ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป และสามารถใช้เปรียบเทียบอัตราการสลายตัวของธาตุกัมมันตรังสีแต่ละชนิดได้ ตัวย่างครึ่งชีวิตของไอโซโทปกัมมันตรังสีบางชนิด ครึ่งชีวิตของธาตุกัมมันตรังสีชนิดต่างๆมีค่าไม่เท่ากัน เช่น เทคนีเทียม -99 มีครึ่งชีวิต 6 ชั่วโมงเท่านั้น ส่วนยูเรเนียม -235 มีครึ่งชีวิต 4.5 ล้านปี
ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป และสามารถใช้เปรียบเทียบอัตราการสลายตัวของธาตุกัมมันตรังสีแต่ละชนิดได้ ตัวย่างครึ่งชีวิตของไอโซโทปกัมมันตรังสีบางชนิด ครึ่งชีวิตของธาตุกัมมันตรังสีชนิดต่างๆมีค่าไม่เท่ากัน เช่น เทคนีเทียม -99 มีครึ่งชีวิต 6 ชั่วโมงเท่านั้น ส่วนยูเรเนียม -235 มีครึ่งชีวิต 4.5 ล้านปี
ครึ่งชีวิต (half life) ของสารกัมมันตรังสี สามารถนำไปใช้หาอายุอายุสัมบูรณ์ (Absolute Age) เป็นอายุของหินหรือซากดึกดำบรรพ์ ที่สามารถบอกจำนวนปีที่ค่อนข้างแน่นอน การหาอายุสัมบูรณ์ใช้วิธีคำนวณจากครึ่งชีวิต ของธาตุกัมมันตรังสีที่มีอยู่ในหิน หรือซากดึกดำบรรพ์ที่ต้องการศึกษา ธาตุกัมมันตรังสีที่นิยมนำมาหาอายุสัมบูรณ์ได้แก่ ธาตุคาร์บอน – 14 ธาตุโพแทศเซียม – 40 ธตาเรเดียม – 226 และธาตุยูเรเนียม – 238 เป็นต้น การหาอายุสัมบูรณ์มักใช้กับหินที่มีอายุมากเป็นแสนล้านปี เช่น หินแกรนิตบริเวณฝั่งตะวันตกของเกาะภูเก็ต ซึ่งเคยเป็นหินต้นกำเนิดแร่ดีบุกมีอายุสัมบูรณ์ประมาณ 100 ล้านปี ส่วนตะกอนและซากดึกดำบรรพ์ที่มีอายุน้อยกว่า 50,000 ปี มักจะใช้วิธีกัมมันตภาพรังสีคาร์บอน – 14 เช่น ซากหอยนางรมที่วัดเจดีย์หอย อำเภอลาดหลุมแก้ว จังหวัดปทุมธานี มีอายุประมาณ 5,500 ปีของวัตถุโบราณ
นอกจากนั้นยังใช้คำนวณอายุของโลก พบว่าว่าประมาณครึ่งหนึ่งของยูเรเนียมที่มีมาแต่แรกเริ่มได้สลายตัวเป็นตะกั่วไปแล้ว ดังนั้นอายุของโลกคือประมาณครึ่งชีวิตของยูเรเนียม หรือราว 4,500 ล้านปี
นอกจากนั้นยังใช้คำนวณอายุของโลก พบว่าว่าประมาณครึ่งหนึ่งของยูเรเนียมที่มีมาแต่แรกเริ่มได้สลายตัวเป็นตะกั่วไปแล้ว ดังนั้นอายุของโลกคือประมาณครึ่งชีวิตของยูเรเนียม หรือราว 4,500 ล้านปี
ประโยชน์ของครึ่งชีวิต
ครึ่งชีวิตสามารถใช้หาอายุของวัตถุโบราณที่มีธาตุคาร์บอนเป็นองค์ประกอบ เรียกว่าวิธี Radiocarbon Dating ซึ่งคำว่า dating หมายถึง การหาอายุจึงมักใช้หาอายุของวัตถุโบราณที่มีคุณค่าทางประวิติศาสตร์
หลักการสำคัญของการหาอายุวัตถุโบราณโดยวิธี Radiocarbon Dating เป็นหลักการที่อาศัยความรู้เกี่ยวกับกัมมันตภาพรังสีที่เกิดขึ้นเองในอากาศ ตัวการที่สำคัญคือ รังสีคอสมิก ซึงอยู่ในบรรยากาศเหนือพื้นโลก มีความเข้มสูงจนทำให้นิวเคลียสขององค์ประกอบของอากาศแตกตัวออก ให้อนุภาคนิวตรอน แล้วอนุภาคนิวตรอนชนกับไนโตรเจนในอากาศ
ตารางครึ่งชีวิตของธาตุกัมมันตรังสีบางชนิด
ตารางที่ 1 แสดงครึ่งชีวิตของธาตุกัมมันตรังสีบางธาตุและชนิดของการสลายตัว
ข้อควรจำ
1. ในทางปฏิบัติการวัดหาจำนวนนิวเคลียสโดยตรงกระทำได้ยาก และเนื่องจากจำนวนนิวเคลียสในสารหนึ่ง ๆ จะเป็นสัดส่วนกับปริมาณของสารนั้น ๆ ดังนั้นจึงพิจารณาเป็นค่ากัมมันตภาพหรืการวัดมวลแทน ดังนี้
โดยที่ A0 คือกัมมันตภาพที่เวลาเริ่มต้น (t=0)
โดยที่ m0 คือมวลสารตั้งต้นที่เวลาเริ่มต้น (t=0)
ประโยชน์และโทษของธาตุกัมมันตรังสี
ในทางอุตสาหกรรม ใช้รังสีวัดวามหนาของวัสดุในโรงงานผลิตกระดาษ ผลิตแผ่นยาง และแผ่นโลหะ ใช้รังสีในการวิเคราะห์ส่วนประกอบของผลิตภัณฑ์ เช่น โลหะผสม แร่ ถ่านหิน และตรวจสอบรอยเชื่อม–รอนร้าวในโลหะหรือโครงสร้างอาคาร ใช้ยูเรเนียมเป็นเชื้อเพลิงสำหรับผลิตกระแสไฟฟ้าในโรงไฟฟ้านิวเคลียร์
ทางการเกษตร ใช้รังสีในการถนอมอาหารเพื่อยืดอายุการเก็บรักษาอาหาร เพราะรังสีจะทำลายแบคทีเรียและจุลินทรีย์ที่ก่อให้เกิดการเน่าเสียในอาหาร ใช้รังสีเพื่อปรับปรุงพันธุ์พืชให้มีความแข็งแรงต้านทานต่อโรคและแมลง เพื่อเพิ่มผลผลิตให้สูงขึ้นครึ่งชีวิตของธาตุกัมมันตรังสี
ครึ่งชีวิตของธาตุ (half life) หมายถึง ระยะเวลาที่สารสลายตัวไปจนเหลือเพียงครึ่งหนึ่งของปริมาณเดิมใช้สัญลักษณ์เป็น t1/2 นิวเคลียสของธาตุกัมมันตรังสีที่ไม่เสถียร จะสลายตัวและแผ่รังสีได้เองตลอดเวลาโดยไม่ขึ้นอยู่กับอุณหภูมิหรือความดัน อัตราการสลายตัว เป็นสัดส่วนโดยตรงกับจำนวนอนุภาคในธาตุกัมมันตรังสีนั้น ปริมาณการสลายตัวจะบอกเป็นครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป
ตัวอย่างเช่น C-14 มีครึ่งชีวิต 5730 ปี หมายความว่า ถ้ามี C-14 1 กรัม เมื่อเวลาผ่านไป 5730 ปี จะเหลือ C-14 อยู่ 0.5 กรัม และเมื่อเวลาผ่านไปอีก 5730 ปี จะเหลืออยู่ 0.25 กรัม เป็นดังนี้ไปเรื่อยๆ กล่าวได้ว่าทุกๆ 5730 ปี จะเหลือ C-14 เพียงครึ่งหนึ่งของปริมาณเดิม
ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป และสามารถใช้เปรียบเทียบอัตราการสลายตัวของธาตุกัมมันตรังสีแต่ละชนิดได้ ตัวย่างครึ่งชีวิตของไอโซโทปกัมมันตรังสีบางชนิด ครึ่งชีวิตของธาตุกัมมันตรังสีชนิดต่างๆมีค่าไม่เท่ากัน เช่น เทคนีเทียม -99 มีครึ่งชีวิต 6 ชั่วโมงเท่านั้น ส่วนยูเรเนียม -235 มีครึ่งชีวิต 4.5 ล้านปี
ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป และสามารถใช้เปรียบเทียบอัตราการสลายตัวของธาตุกัมมันตรังสีแต่ละชนิดได้ ตัวย่างครึ่งชีวิตของไอโซโทปกัมมันตรังสีบางชนิด ครึ่งชีวิตของธาตุกัมมันตรังสีชนิดต่างๆมีค่าไม่เท่ากัน เช่น เทคนีเทียม -99 มีครึ่งชีวิต 6 ชั่วโมงเท่านั้น ส่วนยูเรเนียม -235 มีครึ่งชีวิต 4.5 ล้านปี
ครึ่งชีวิต (half life) ของสารกัมมันตรังสี สามารถนำไปใช้หาอายุอายุสัมบูรณ์ (Absolute Age) เป็นอายุของหินหรือซากดึกดำบรรพ์ ที่สามารถบอกจำนวนปีที่ค่อนข้างแน่นอน การหาอายุสัมบูรณ์ใช้วิธีคำนวณจากครึ่งชีวิต ของธาตุกัมมันตรังสีที่มีอยู่ในหิน หรือซากดึกดำบรรพ์ที่ต้องการศึกษา ธาตุกัมมันตรังสีที่นิยมนำมาหาอายุสัมบูรณ์ได้แก่ ธาตุคาร์บอน – 14 ธาตุโพแทศเซียม – 40 ธตาเรเดียม – 226 และธาตุยูเรเนียม – 238 เป็นต้น การหาอายุสัมบูรณ์มักใช้กับหินที่มีอายุมากเป็นแสนล้านปี เช่น หินแกรนิตบริเวณฝั่งตะวันตกของเกาะภูเก็ต ซึ่งเคยเป็นหินต้นกำเนิดแร่ดีบุกมีอายุสัมบูรณ์ประมาณ 100 ล้านปี ส่วนตะกอนและซากดึกดำบรรพ์ที่มีอายุน้อยกว่า 50,000 ปี มักจะใช้วิธีกัมมันตภาพรังสีคาร์บอน – 14 เช่น ซากหอยนางรมที่วัดเจดีย์หอย อำเภอลาดหลุมแก้ว จังหวัดปทุมธานี มีอายุประมาณ 5,500 ปีของวัตถุโบราณ
นอกจากนั้นยังใช้คำนวณอายุของโลก พบว่าว่าประมาณครึ่งหนึ่งของยูเรเนียมที่มีมาแต่แรกเริ่มได้สลายตัวเป็นตะกั่วไปแล้ว ดังนั้นอายุของโลกคือประมาณครึ่งชีวิตของยูเรเนียม หรือราว 4,500 ล้านปี
นอกจากนั้นยังใช้คำนวณอายุของโลก พบว่าว่าประมาณครึ่งหนึ่งของยูเรเนียมที่มีมาแต่แรกเริ่มได้สลายตัวเป็นตะกั่วไปแล้ว ดังนั้นอายุของโลกคือประมาณครึ่งชีวิตของยูเรเนียม หรือราว 4,500 ล้านปี
ประโยชน์ของครึ่งชีวิต
ครึ่งชีวิตสามารถใช้หาอายุของวัตถุโบราณที่มีธาตุคาร์บอนเป็นองค์ประกอบ เรียกว่าวิธี Radiocarbon Dating ซึ่งคำว่า dating หมายถึง การหาอายุจึงมักใช้หาอายุของวัตถุโบราณที่มีคุณค่าทางประวิติศาสตร์
หลักการสำคัญของการหาอายุวัตถุโบราณโดยวิธี Radiocarbon Dating เป็นหลักการที่อาศัยความรู้เกี่ยวกับกัมมันตภาพรังสีที่เกิดขึ้นเองในอากาศ ตัวการที่สำคัญคือ รังสีคอสมิก ซึงอยู่ในบรรยากาศเหนือพื้นโลก มีความเข้มสูงจนทำให้นิวเคลียสขององค์ประกอบของอากาศแตกตัวออก ให้อนุภาคนิวตรอน แล้วอนุภาคนิวตรอนชนกับไนโตรเจนในอากาศ
ตารางครึ่งชีวิตของธาตุกัมมันตรังสีบางชนิด
ตารางที่ 1 แสดงครึ่งชีวิตของธาตุกัมมันตรังสีบางธาตุและชนิดของการสลายตัว
ข้อควรจำ
1. ในทางปฏิบัติการวัดหาจำนวนนิวเคลียสโดยตรงกระทำได้ยาก และเนื่องจากจำนวนนิวเคลียสในสารหนึ่ง ๆ จะเป็นสัดส่วนกับปริมาณของสารนั้น ๆ ดังนั้นจึงพิจารณาเป็นค่ากัมมันตภาพหรืการวัดมวลแทน ดังนี้
โดยที่ A0 คือกัมมันตภาพที่เวลาเริ่มต้น (t=0)
โดยที่ m0 คือมวลสารตั้งต้นที่เวลาเริ่มต้น (t=0)
ประโยชน์และโทษของธาตุกัมมันตรังสี
ในทางอุตสาหกรรม ใช้รังสีวัดวามหนาของวัสดุในโรงงานผลิตกระดาษ ผลิตแผ่นยาง และแผ่นโลหะ ใช้รังสีในการวิเคราะห์ส่วนประกอบของผลิตภัณฑ์ เช่น โลหะผสม แร่ ถ่านหิน และตรวจสอบรอยเชื่อม–รอนร้าวในโลหะหรือโครงสร้างอาคาร ใช้ยูเรเนียมเป็นเชื้อเพลิงสำหรับผลิตกระแสไฟฟ้าในโรงไฟฟ้านิวเคลียร์
ทางการเกษตร ใช้รังสีในการถนอมอาหารเพื่อยืดอายุการเก็บรักษาอาหาร เพราะรังสีจะทำลายแบคทีเรียและจุลินทรีย์ที่ก่อให้เกิดการเน่าเสียในอาหาร ใช้รังสีเพื่อปรับปรุงพันธุ์พืชให้มีความแข็งแรงต้านทานต่อโรคและแมลง เพื่อเพิ่มผลผลิตให้สูงขึ้นครึ่งชีวิตของธาตุกัมมันตรังสี
ครึ่งชีวิตของธาตุ (half life) หมายถึง ระยะเวลาที่สารสลายตัวไปจนเหลือเพียงครึ่งหนึ่งของปริมาณเดิมใช้สัญลักษณ์เป็น t1/2 นิวเคลียสของธาตุกัมมันตรังสีที่ไม่เสถียร จะสลายตัวและแผ่รังสีได้เองตลอดเวลาโดยไม่ขึ้นอยู่กับอุณหภูมิหรือความดัน อัตราการสลายตัว เป็นสัดส่วนโดยตรงกับจำนวนอนุภาคในธาตุกัมมันตรังสีนั้น ปริมาณการสลายตัวจะบอกเป็นครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป
ตัวอย่างเช่น C-14 มีครึ่งชีวิต 5730 ปี หมายความว่า ถ้ามี C-14 1 กรัม เมื่อเวลาผ่านไป 5730 ปี จะเหลือ C-14 อยู่ 0.5 กรัม และเมื่อเวลาผ่านไปอีก 5730 ปี จะเหลืออยู่ 0.25 กรัม เป็นดังนี้ไปเรื่อยๆ กล่าวได้ว่าทุกๆ 5730 ปี จะเหลือ C-14 เพียงครึ่งหนึ่งของปริมาณเดิม
ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป และสามารถใช้เปรียบเทียบอัตราการสลายตัวของธาตุกัมมันตรังสีแต่ละชนิดได้ ตัวย่างครึ่งชีวิตของไอโซโทปกัมมันตรังสีบางชนิด ครึ่งชีวิตของธาตุกัมมันตรังสีชนิดต่างๆมีค่าไม่เท่ากัน เช่น เทคนีเทียม -99 มีครึ่งชีวิต 6 ชั่วโมงเท่านั้น ส่วนยูเรเนียม -235 มีครึ่งชีวิต 4.5 ล้านปี
ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป และสามารถใช้เปรียบเทียบอัตราการสลายตัวของธาตุกัมมันตรังสีแต่ละชนิดได้ ตัวย่างครึ่งชีวิตของไอโซโทปกัมมันตรังสีบางชนิด ครึ่งชีวิตของธาตุกัมมันตรังสีชนิดต่างๆมีค่าไม่เท่ากัน เช่น เทคนีเทียม -99 มีครึ่งชีวิต 6 ชั่วโมงเท่านั้น ส่วนยูเรเนียม -235 มีครึ่งชีวิต 4.5 ล้านปี
ครึ่งชีวิต (half life) ของสารกัมมันตรังสี สามารถนำไปใช้หาอายุอายุสัมบูรณ์ (Absolute Age) เป็นอายุของหินหรือซากดึกดำบรรพ์ ที่สามารถบอกจำนวนปีที่ค่อนข้างแน่นอน การหาอายุสัมบูรณ์ใช้วิธีคำนวณจากครึ่งชีวิต ของธาตุกัมมันตรังสีที่มีอยู่ในหิน หรือซากดึกดำบรรพ์ที่ต้องการศึกษา ธาตุกัมมันตรังสีที่นิยมนำมาหาอายุสัมบูรณ์ได้แก่ ธาตุคาร์บอน – 14 ธาตุโพแทศเซียม – 40 ธตาเรเดียม – 226 และธาตุยูเรเนียม – 238 เป็นต้น การหาอายุสัมบูรณ์มักใช้กับหินที่มีอายุมากเป็นแสนล้านปี เช่น หินแกรนิตบริเวณฝั่งตะวันตกของเกาะภูเก็ต ซึ่งเคยเป็นหินต้นกำเนิดแร่ดีบุกมีอายุสัมบูรณ์ประมาณ 100 ล้านปี ส่วนตะกอนและซากดึกดำบรรพ์ที่มีอายุน้อยกว่า 50,000 ปี มักจะใช้วิธีกัมมันตภาพรังสีคาร์บอน – 14 เช่น ซากหอยนางรมที่วัดเจดีย์หอย อำเภอลาดหลุมแก้ว จังหวัดปทุมธานี มีอายุประมาณ 5,500 ปีของวัตถุโบราณ
นอกจากนั้นยังใช้คำนวณอายุของโลก พบว่าว่าประมาณครึ่งหนึ่งของยูเรเนียมที่มีมาแต่แรกเริ่มได้สลายตัวเป็นตะกั่วไปแล้ว ดังนั้นอายุของโลกคือประมาณครึ่งชีวิตของยูเรเนียม หรือราว 4,500 ล้านปี
นอกจากนั้นยังใช้คำนวณอายุของโลก พบว่าว่าประมาณครึ่งหนึ่งของยูเรเนียมที่มีมาแต่แรกเริ่มได้สลายตัวเป็นตะกั่วไปแล้ว ดังนั้นอายุของโลกคือประมาณครึ่งชีวิตของยูเรเนียม หรือราว 4,500 ล้านปี
ประโยชน์ของครึ่งชีวิต
ครึ่งชีวิตสามารถใช้หาอายุของวัตถุโบราณที่มีธาตุคาร์บอนเป็นองค์ประกอบ เรียกว่าวิธี Radiocarbon Dating ซึ่งคำว่า dating หมายถึง การหาอายุจึงมักใช้หาอายุของวัตถุโบราณที่มีคุณค่าทางประวิติศาสตร์
หลักการสำคัญของการหาอายุวัตถุโบราณโดยวิธี Radiocarbon Dating เป็นหลักการที่อาศัยความรู้เกี่ยวกับกัมมันตภาพรังสีที่เกิดขึ้นเองในอากาศ ตัวการที่สำคัญคือ รังสีคอสมิก ซึงอยู่ในบรรยากาศเหนือพื้นโลก มีความเข้มสูงจนทำให้นิวเคลียสขององค์ประกอบของอากาศแตกตัวออก ให้อนุภาคนิวตรอน แล้วอนุภาคนิวตรอนชนกับไนโตรเจนในอากาศ
ตารางครึ่งชีวิตของธาตุกัมมันตรังสีบางชนิด
ตารางที่ 1 แสดงครึ่งชีวิตของธาตุกัมมันตรังสีบางธาตุและชนิดของการสลายตัว
ข้อควรจำ
1. ในทางปฏิบัติการวัดหาจำนวนนิวเคลียสโดยตรงกระทำได้ยาก และเนื่องจากจำนวนนิวเคลียสในสารหนึ่ง ๆ จะเป็นสัดส่วนกับปริมาณของสารนั้น ๆ ดังนั้นจึงพิจารณาเป็นค่ากัมมันตภาพหรืการวัดมวลแทน ดังนี้
โดยที่ A0 คือกัมมันตภาพที่เวลาเริ่มต้น (t=0)
โดยที่ m0 คือมวลสารตั้งต้นที่เวลาเริ่มต้น (t=0)
ประโยชน์และโทษของธาตุกัมมันตรังสี
ในทางอุตสาหกรรม ใช้รังสีวัดวามหนาของวัสดุในโรงงานผลิตกระดาษ ผลิตแผ่นยาง และแผ่นโลหะ ใช้รังสีในการวิเคราะห์ส่วนประกอบของผลิตภัณฑ์ เช่น โลหะผสม แร่ ถ่านหิน และตรวจสอบรอยเชื่อม–รอนร้าวในโลหะหรือโครงสร้างอาคาร ใช้ยูเรเนียมเป็นเชื้อเพลิงสำหรับผลิตกระแสไฟฟ้าในโรงไฟฟ้านิวเคลียร์
ทางการเกษตร ใช้รังสีในการถนอมอาหารเพื่อยืดอายุการเก็บรักษาอาหาร เพราะรังสีจะทำลายแบคทีเรียและจุลินทรีย์ที่ก่อให้เกิดการเน่าเสียในอาหาร ใช้รังสีเพื่อปรับปรุงพันธุ์พืชให้มีความแข็งแรงต้านทานต่อโรคและแมลง เพื่อเพิ่มผลผลิตให้สูงขึ้น






























ไม่มีความคิดเห็น:
แสดงความคิดเห็น